GVP逐条谈 | 45.关联性评价,切忌“讳疾忌医”
- 2021-08-11 15:12
- 作者:于伟强
- 来源:中国食品药品网
关联性评价应科学、客观;关联性评价是持有人维护安全性信息的依据。
【条文】
《药物警戒质量管理规范》第四章 监测与报告
第二节 报告的评价与处置
第四十五条 持有人应当按照国家药品不良反应监测机构发布的药品不良反应关联性分级评价标准,对药品与疑似不良反应之间的关联性进行科学、客观的评价。
对于自发报告,如果报告者未提供关联性评价意见,应当默认药品与疑似不良反应之间存在关联性。
如果初始报告人进行了关联性评价,若无确凿医学证据,持有人原则上不应降级评价。
【理解】
·什么是关联性评价?
关联性评价,又叫做相关性评价或医学评审,用以评价药物-事件组合的相关性,从而判断一个事件是否为不良反应。
·关联性评价结果分级
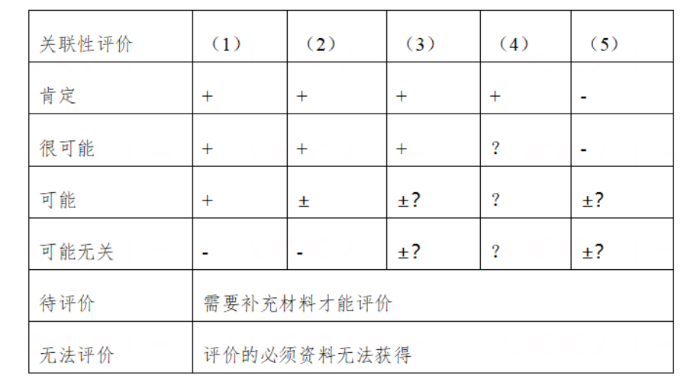
(1)根据世界卫生组织(WHO)相关指导原则,关联性评价结果分为肯定、很可能、可能、可能无关、待评价、无法评价6级。
(2)其他国内常用的评判结果还包括:
> 七分法:肯定、很可能、可能、可疑、不相关、待评价、无法评价/判 断;
> 六分法:肯定、很可能、可能、可疑、待评价、无法评价/判断;
> 五分法:肯定相关、很可能相关、可能相关、可能无关、不相关;
> 二分法:相关、不相关。
·中国关联性评价方法:
目前中国的关联性评价方法主要为通过对五项不良反应分析内容做出选择,进而在6级关联性评价中做出选择。
此方法多用于药品上市后个例不良反应的评价,新药临床试验中采用可能存在一定局限性,仅供申办者和研究者参考。
五项不良反应分析内容如下:用药与不良反应的出现有无合理的时间关系;反应是否符合该药已知的不良反应类型;停药或减量后反应是否消失或减轻;再次使用可疑药品是否再次出现同样反应;反应是否可用并用药物的作用、患者病情的进展或其它治疗措施来解释。
依据5项分析选择结果做出关联性评价:
考虑到同一种语言中,不同的人对术语的含义和权重(probably vs. possibly vs. likely,很可能、可能、极可能等)几乎没有一致意见,为了使研究者给出更确切的评价,CIOMS VI工作组建议要求研究者对严重不良事件的药物因果关系使用简单的二分法(有关或无关)。
·关联性评价的原则
科学:报告中的多种因素可能会干扰因果关系判断,如原患疾病、并用药品或药品存在可疑的质量问题等,评价人员应科学评估,不能盲目将这些因素作为排除药品与不良反应关联性的理由,从而不予上报;
客观:不夸大、不遗漏任何信息,应基于合理的理由及证据判断药物-事件相关性。
从严:报告者作为直接与患者接触的医疗或相关的人员,是掌握患者情况的第一来源。因此持有人在评估关联性时需要充分考虑报告者的意见,在报告者提供的信息和科学的评估方法的基础上,谨慎地进行评估;在缺少必要信息的情况下,需要以尽可能保守的方式从严评估,避免遗漏需要上报的个例报告。
> 为了满足可疑即报的原则,对于自发来源的报告,报告中没有对关联性做出评估的情况下,企业在评估不良事件与怀疑药品的关联性时,应当默认其为有关联。
> 持有人不应对初始报告人的关联性评价的报告进行降级评价,即持有人对关联性的评价应高于或等于报告者的评价;
> 如果持有人需要进行降级评价,则需要有充分的医学证据,并在企业的意见中做出说明。
·关联性评价的应用
不良事件通过关联性评价,可以筛选出药物不良反应。持有人应对这些不良反应不断进行评估,以确认这些不良反应是否需要在IB、药品说明书或是RSI中进行更新或修订,以优化产品的持续安全使用。
【实践影响】
在临床试验期间,需注意切忌因上市申请的顾虑,而忽略对安全性事件的收集和客观评价。
【延伸阅读】
《个例药品不良反应收集和报告指导原则》
CIOMS VI
WHO评价方法
(浙江太美医疗科技股份有限公司 于伟强)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐
-

-

执法实务|关于无证医疗器械认定的探讨
准确认定无证医疗器械,是有效打击相关违法行为、净化市场环境、保障公众用械安全的关键环节。但由于市场上产品形态多样、违法行为隐蔽等因素,使无证医疗器械的认定工作日趋复杂。本文对无证医... 2025-10-21 16:37
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有