GVP逐条谈 | 69.药品上市后安全性研究,应该怎么做?
- 2021-09-01 14:50
- 作者:钱叙辰
- 来源:中国食品药品网
本文阐释了药品上市后安全性研究(Post Authorization Safety Study, PASS)的定义。
【条文】
《药物警戒质量管理规范》第五章 风险识别与评估
第三节 药品上市后安全性研究
第六十九条 药品上市后开展的以识别、定性或定量描述药品安全风险,研究药品安全性特征,以及评估风险控制措施实施效果为目的的研究,均属于药品上市后安全性研究。
【理解】
·上市后药品安全风险的识别
药品安全性风险贯穿药物研发上市的全生命周期。如何去识别这些潜在风险,便成了持有人、医生和患者以及监管机构共同关注的问题。
持有人可以通过主动监测和被动监测两种方法去预知识别药物上市前临床试验中未发现或者当时作用不显著的安全性风险。
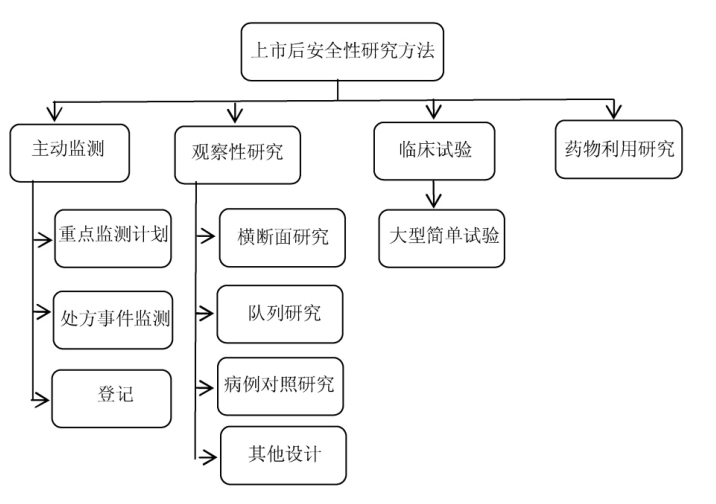
主动监测
可通过下述方式进行:哨点监测;药物事件监测;登记。
被动监测
包含自发性报告和病例系列报告,多由医生或者研究者报告给监管机构和/或持有人。但是值得注意的是,被动监测并不属于上市后持有人主动开展的安全性研究。
·药品安全性风险的描述方法
药品安全性风险可以进行定性或者定量化的描述。
定性描述是通过观测、实验和分析等,考察这种风险具备何种属性和特征。例如链霉素具备耳和肾毒性相关安全性风险,耳和肾即是该安全性风险的器官属性。
同时,我们还可对药品安全性风险作定量化的描述,并运用统计分析的方法加以分析,例如某风险的发生率,某安全性风险和药品本身的相关系数。
·药品安全性特征
药品各不良事件发生次数、发生率,与不良事件发生的药物暴露剂量,药品各不良事件累及的器官等等,以及运用定性或者定量的描述对不同药物、或同一种药物不同制剂作出的安全性评价,有助于持有人和监管机构对药物的安全性总体“印象”勾勒出特征。
在实践过程中,持有人或者监管机构可通过对汇总的上市后安全性资料进行系统评价和汇总分析,从而归纳出药物的安全性特征。这类研究也属于上市后药物安全性研究。
·评价风险控制措施实施效果的研究
在药品上市时,监管机构会要求持有人向医生及公众告知安全性风险,并通过药品说明书、制定药物指南,规定确保安全使用要素,开发风险控制相关执行系统,定期填写评价时间表等方法对安全性风险进行管理和控制。
在措施实施一定时间后,需要对风险管理措施进行修订和更新。如持有人认为已实现预期的风险控制目标,就需要及时降低管理控制措施的强度。
在此之前,必须要对当前风险管理措施实施的效果进行评估。这类对药品风险控制措施进行评价的研究也属于药品上市后安全性研究的范畴。
【实践影响】
本法条阐释了药品上市后安全性研究的定义,规定该类研究的总体目标,并涵盖了上市后安全性研究的主要类型。
【延伸阅读】
欧盟《药物警戒实践指南》 2017年更新版 模块VIII
欧盟《药物警戒实践指南》 2012版 模块VIII
ICH E2E文件
(浙江太美医疗科技股份有限公司 高级医学专员 钱叙辰)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐
-

强化注册管理 从严委托监管 ——浅析《关于进一步加强医疗器械注册人委托生产监督管理的公告》亮点
《关于进一步加强医疗器械注册人委托生产监督管理的公告》从企业主体、注册管理、监督检查等方面进一步厘清了重点细节和各方责任。 2024-05-09 14:27 -