罕见病药物研发前景分析
- 2021-09-08 10:43
- 作者:王宇恒
- 来源:中国食品药品网
罕见病是指发病率低,病情较为严重,诊断治疗较为复杂的疾病。目前全球罕见病约有7000-8000种,约有3.5亿人受其影响。80%的罕见病是遗传性疾病,50%的罕见病通常于患者儿童时期发病,且这些罕见病会严重影响儿童的寿命和生存质量。目前在全球还没有统一的罕见病的定义,世界各国根据自己国家的具体情况对罕见病的认定标准存在一定差异。比较主流的定义有三种:一是欧洲议会和委员会于1999年12月16日颁布的《孤儿药条例》,对罕见病定义为患病率低于5/10000的慢性/渐进性且威胁生命的疾病;二是美国于2002年通过的《罕见病法案》,将罕见病定义为在美国患病人数低于20万人的疾病;三是2018年3月1日根据世界卫生组织的定义,罕见病是指患病人数占总人口0.65‰~1‰的疾病。
全球目前只有10%的罕见病患者能够得到治疗,大部分罕见病患者面临无药可治的境地。造成这种局面的主要原因是:对于罕见病等特定疾病没有有效和安全的治疗方法;当有疗法时,其临床关联度和成本效果不明确,医务人员缺乏相关罕见病知识和训练,缺乏相应诊断体系,且药品价格过高,导致罕见病药物的可支付性很低。
目前全球90%的罕见病没有有效的诊疗方法,市场空缺极大。我国罕见病药品较为短缺且主要依赖进口,这些进口药品价格高昂,大量患者无力承担。而我国庞大的人口基数注定了规模较大的罕见病患者群体。根据石鑫淼等人的研究,2014-2015年我国96家三甲医院中,罕见病例次占到同期住院总例次的0.35%。另据估计,我国罕见病患者人数约为1680万。鉴于罕见病的异质性较大,各罕见病患病率不一,在各个人种中患病率也不尽相同,加快罕见病用药新药的研发以惠及更多的国内罕见病患者迫在眉睫。当下我国罕见病药品政策仍处于窗口期,加大力度促进国内罕见病用药的研发,无疑是一个黄金时期。
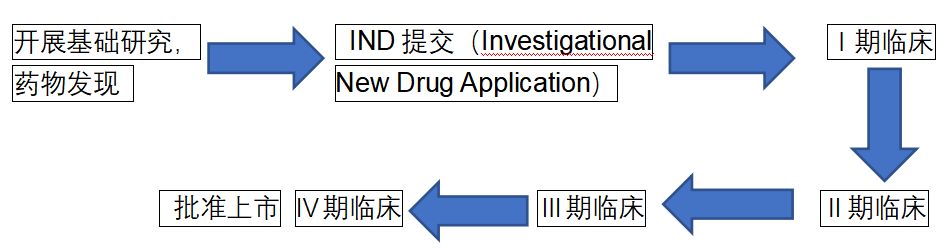
图片:药物研发流程示意图
上图是药物研发的流程示意图。一个新药的研发要经历长期繁琐的流程,一般需要6-7年甚至更长时间。这还只是一般性药物研发,罕见病药物研发时间和费用投入更加漫长和巨大。
绝大多数罕见病的发病机制、诊疗方法不明确,并且罕见病病例少,患者分散,数据采集非常困难,往往无法引起社会各界的重视,制药企业对罕见病药物往往有“收益不确定”的担忧,缺乏研发、仿制及生产罕见病用药的动力。即便药企具备了研发生产罕见病用药的动机,罕见病患者数量极少也导致传统的随机对照临床试验的可行性比较差。
患者组织可以有效解决这一难题。
通过建立罕见病患者社群组织,可以有效推动罕见病的诊疗发展以及药物研发。拥有一定患者数量的社群组织可以寻找企业研发的合作伙伴,推动罕见病的基础研究,开展临床试验。罕见病患者通过登记找到社群,增加参与临床研究的机会,帮助新药研发科学家调查哪种症状对患者影响最大,充分理解疾病,确定新药研究的方向。
在欧美国家,患者社群组织在整个医药产业中发挥着重要作用,在很多孤儿药的研发中甚至起到了“源动力”作用。通过与医药产业链中各利益相关方合作,加速基础研究、药物临床试验和上市。1983年的美国《孤儿药法案》,为开发罕见病药物研发的公司提供了激励政策。从那时起到2019年,有超过600种针对不同适应症的药物被批准用于治疗罕见病。相比之下,上世纪70年代仅有不到10种罕见病药物。激励政策包括:新药七年市场独占期;合格研究费用的50%税收抵免;资助开发等。
在我国,2018年10月,国家药监局联合国家卫生健康委发布《临床急需境外新药审评审批工作程序》,对临床急需的境外新药采取了专门通道进行审批,品种范围是近10年在美国、欧盟或日本上市但未在我国境内上市的新药,符合下列情形之一的:用于治疗罕见病的药品;用于防治严重危及生命疾病,且尚无有效治疗或预防手段的药品;用于防治严重危及生命疾病,且具有明显临床优势的药品。此外明确要求对于罕见病治疗药品,国家药监局药审中心在受理3个月内完成技术审评。以2018年5月国家卫生健康委联合五部门发布的《第一批罕见病目录》为统计依据,目前在我国已经上市的治疗罕见病的药物数量63个(已纳入国家医保目录38种),涉及罕见病数量35种,未来三年,随着我国药政改革的稳步推进,临床急需境外新药名单和优先审评审批通道中的罕见病药物将陆续获批上市,预计有近百种罕见病药物有望在我国上市,给翘首以盼的罕见病患者带来希望。
针对罕见病用药的基础和临床研究不仅促进罕见病诊断和治疗技术的发展,还有助于一般常见疾病的发病机制研究和药物研发。当前我国医药产业特别是生物制药领域正处于高速发展时期,罕见病用药的研发和生产还处于起步阶段。促进罕见病用药研发的受益者不仅是广大患者,还包括处在成长阶段迫切需要各种资源支持的生物科技公司等。本土创新研发必定也会提升我国医药学的研发能力,符合《“健康中国2030”规划纲要》提出的远大战略目标。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
- CDE公开征求《以患者为中心的罕见疾病药物研发试点工作计划(“关爱计划”)》申报指南和实施框架意见
- CDE将ALXN2350注射液纳入《以患者为中心的罕见疾病药物研发试点工作计划(“关爱计划”)》试点项目
-
为你推荐












