麻醉深度监测仪,是Ⅱ类还是Ⅲ类医疗器械?
- 2021-09-14 16:16
- 作者:王张明
- 来源:中国食品药品网
争议缘起
2019年2月18日,中国食品药品检定研究院发布《2018年医疗器械产品分类界定结果汇总》,其中列明“一、按照Ⅲ类医疗器械管理的产品(69个)……28.麻醉深度监测仪:由主机、电源适配器、导联线和功能接地线组成。设备采集患者脑电波数据,并在主机运算处理后,得出麻醉深度指数数值,并对该参数进行监测。分类编码:07-04。”
2018年9月28日,国家药品监督管理局发布了《关于公布新修订免于进行临床试验医疗器械目录的通告》,其序号为322的产品名称为“多参数监护仪”,分类编码为“07-04-01”,产品描述为“多参数监护仪主要由主机和附件组成,附件可以包括心电导联电缆、血压袖带、血氧探头、体温探头、呼吸气体测量组件、麻醉深度外接配件等,可按设计、型式、技术参数、附加辅助功能等不同分为若干型号;供患者的心电、无创血压、脉搏、血氧饱和度、体温、呼吸、呼吸气体、麻醉深度指数监测用。需提供无创血压系统整体有效性和血氧准确度人体评估报告。产品性能指标采用下列参考标准中的适用部分,如: YY 1079-2008心电监护仪、YY 0670-2008无创自动测量血压计、YY 0784-2010医用电气设备——医用脉搏血氧仪设备基本安全和主要性能专用要求、YY 0785-2010临床体温计——连续测量的电子体温计性能要求、YY 0667-2008 医用电气设备——自动循环无创血压监护设备的安全和基本性能专用要求等”,类别为“Ⅱ”。
上述两个文件所列产品似乎并无交集,一个产品为麻醉深度监测仪,另一个产品为多参数监护仪。但仔细比较后发现,他们的分类编码一个是“07-04”,另一个是“07-04-01”,这个分类编码是与2017年8月31日原国家食品药品监督管理总局发布的《医疗器械分类目录》相对应的。“07-04”、“07-04-01”分别对应《医疗器械分类目录》“07医用诊察和监护器械-04监护设备”和“07医用诊察和监护器械-04监护设备-01病人监护设备”,它们处在同一分类编码中。多参数监护仪产品描述中涉及到了麻醉深度,多参数监护仪产品附件可包括麻醉深度外接配件,用途可以包括麻醉深度指数监测用。比较两者的描述后,我们可以得出这样的结论,《关于公布新修订免于进行临床试验医疗器械目录的通告》中涉及的多参数监护仪包含了《2018年医疗器械产品分类界定结果汇总》中涉及的麻醉深度监测仪,它们之间是包含与被包含的关系。
从两者的描述我们可以得出,多参数监护仪包含麻醉深度监测仪,但《2018年医疗器械产品分类界定结果汇总》明确麻醉深度监测仪管理类别为Ⅲ类,而《关于公布新修订免于进行临床试验医疗器械目录的通告》明确多参数监护仪管理类别为Ⅱ类。
在2017版的《医疗器械分类目录》里07-04下的监护设备的预期用途里并未见有麻醉深度相关内容。
那么,麻醉深度监测仪究竟是按Ⅱ类还是按Ⅲ类医疗器械管理呢?
注册现状
笔者在国家药监局官方网站数据库查询,在医疗器械数据库-国产医疗器械产品(注册)中查询到涉及麻醉深度监测产品21个,涉及浙江、上海、广东等7个省市的17个厂家。在《2018年医疗器械产品分类界定结果汇总》发布之前,共有13个产品注册,均按Ⅱ类医疗器械注册;在该文件发布日之后,共有8个产品注册,除浙江一洋医疗科技有限公司在2020年3月13日在国家药监局取得了Ⅲ类医疗器械注册证外,其他7个产品均按Ⅱ类医疗器械在企业所在省、直辖市取得了产品注册证。
在医疗器械数据库-国产器械(历史数据)中查询到涉及麻醉深度监测产品37个,涉及浙江、海南、广东、安徽等多个省份,产品均按Ⅱ类医疗器械在企业所在省、直辖市取得了产品注册证。
在医疗器械数据库-进口医疗器械产品(注册)中未查询到数据。
在医疗器械数据库-进口器械(历史数据)中,笔者查询到两条数据,其管理类别并不相同,一个按Ⅱ类管理,一个按Ⅲ类管理,注册证号分别为国食药监械(进)字2004第2212521号、国食药监械(进)字2005第3213117号。
综上,通过有据可查的数据我们发现,自2004年以来,我国共有60个麻醉深度仪类产品被审批,其中除了2005年许可给丹麦Danmeter A/S Denmark以及2020年许可给浙江一洋医疗科技有限公司的麻醉深度监护仪为Ⅲ类医疗器械之外,其他均为各省或国家局注册的Ⅱ类医疗器械。
思考
为明晰麻醉深度监测仪究竟是按Ⅱ类还是按Ⅲ类管理,我们需从注册现状入手,对同时期注册的Ⅲ类和Ⅱ类麻醉深度监护仪进行分析,以确定管理类别不同的原因。
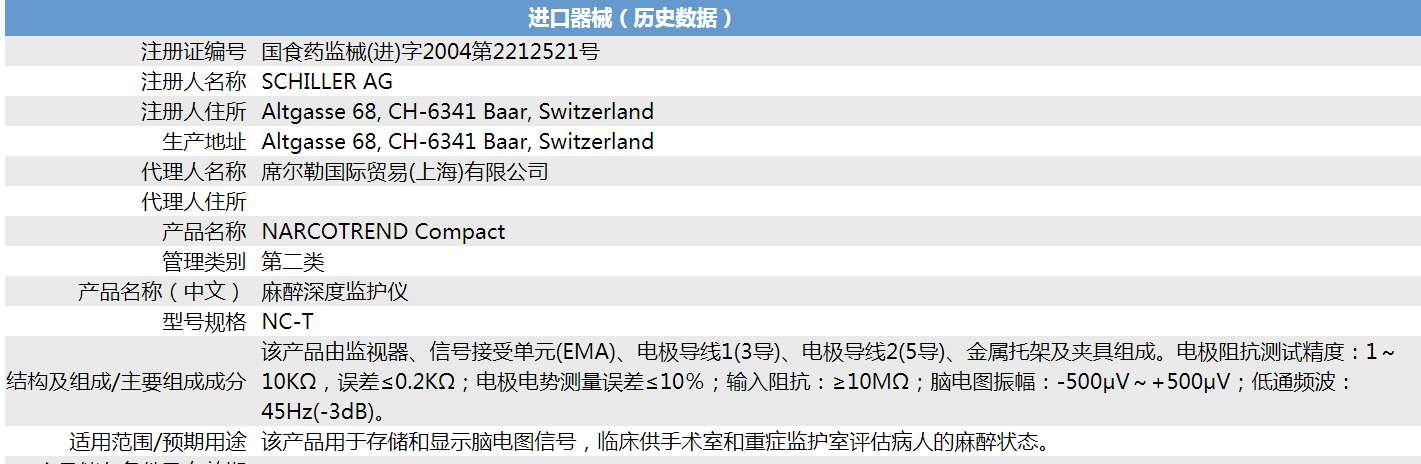
首先,分析进口医疗器械的审批数据。在医疗器械数据库-进口器械(历史数据)中查询到两条数据,其中之一产品具体情况为:
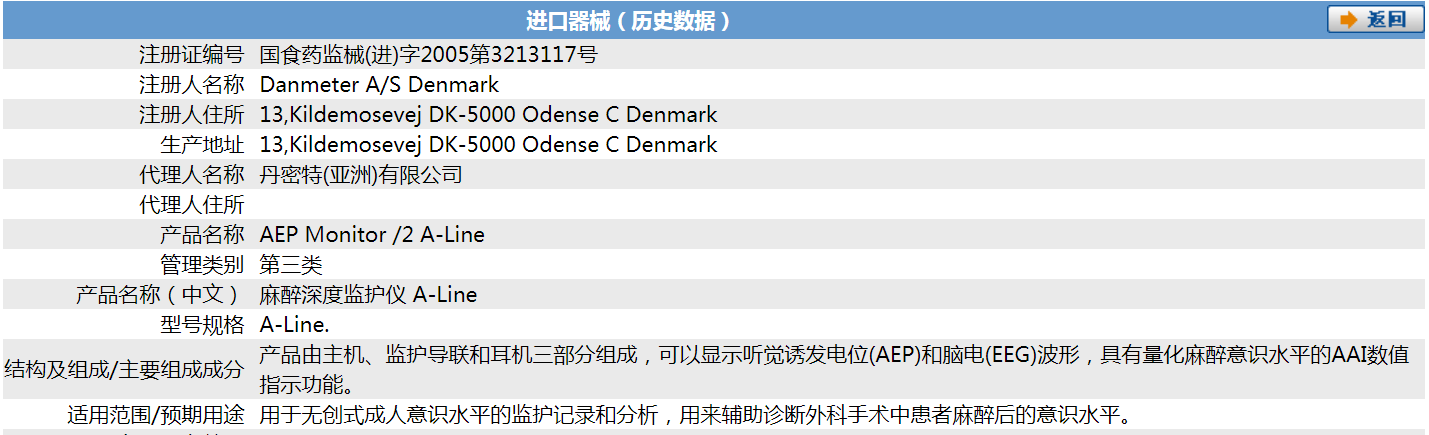
另一产品具体情况为:
从两者的注册证号,我们可知它们的品种编码均为6821,对应2002年版《医疗器械分类目录》中的6821 医用电子仪器设备,但在该品种编码下的品名举例中未见有麻醉深度监护仪,与该仪器相关的内容有“脑电诊断仪器”,品名举例有“脑电图机、脑电阻仪、脑电波分析仪、脑地形图仪、脑电实时分析记录仪”,管理类别为“Ⅱ”。
对比上述两个产品,我们发现:按Ⅱ类医疗器械审批的麻醉深度监护仪只是存储和显示脑电图信号,临床供手术室和重症监护室评估病人的麻醉状态;而按Ⅲ类医疗器械审批的麻醉深度监护仪却多了耳机等听觉诱发电位(AEP)设备,而且具有量化麻醉意识水平的AAI数值指示功能。进一步分析可知,按Ⅱ类医疗器械审批的麻醉深度监护仪,其实是具有脑电波监测的多参数监护仪;按Ⅲ类医疗器械审批的麻醉深度监护仪,却是可以量化麻醉意识水平,具有AAI数值指示功能的名副其实的麻醉深度监护仪。
我们再来分析国产医疗器械审批的数据。
作为唯一一个获得Ⅲ类医疗器械注册证的产品,浙江一洋科技有限公司在2020年获批注册的麻醉深度监测仪的结构及组成是“由主机、电源线、麻醉深度导联线组成”以及“适用范围/预期用途:临床用于成人患者脑电信号采集以及麻醉状态监测”。
同为2020年注册的其他麻醉深度监护仪产品,其结构及组成为“由主机、电源适配器、锂离子电池(内置)、脑电导联线和一次性麻醉深度监护传感器(外购)组成”“适用范围/预期用途为:用于监测患者麻醉深度指数”。
两相比较,无论是结构及组成,还是适用范围,均未发现有重大区别,但一个按Ⅲ类注册,一个按Ⅱ类注册。为什么会出现这样的不同?
《2018年医疗器械产品分类界定结果汇总》的信息,是企业依据当时施行的《医疗器械监督管理条例》(2014年版)第十六条“对新研制的尚未列入分类目录的医疗器械,申请人可以依照本条例有关第三类医疗器械产品注册的规定直接申请产品注册,也可以依据分类规则判断产品类别并向国务院食品药品监督管理部门申请类别确认后依照本条例的规定申请注册或者进行产品备案”,向国家药监局提交申请类别确认,经具体负责该项工作的医疗器械标准管理中心确定医疗器械分类结果后的一个汇总。
我们可以推论,这个申请麻醉深度监护仪类别确认的企业应当就是浙江一洋科技有限公司,在得到标管中心类别确认后,企业按照Ⅲ类医疗器械向国家药监局提交了注册申请,并在2020年取得了产品注册证书。而同为2020年注册的其他麻醉深度监护仪产品,由于无论是2002年版的《医疗器械分类目录》还是2017版《医疗器械分类目录》均未明确载明麻醉深度监护仪,而且由于历史审批以及国家药品监督管理局发布的《关于公布新修订免于进行临床试验医疗器械目录的通告》中“多参数监护仪”,产品描述中存在“麻醉深度外接配件”“麻醉深度指数监测用”,并明确该产品类别为“Ⅱ”的原因,导致不少省级药监督部门,将该仪器注册为Ⅱ类。企业所在省依旧按照原来审批的模式,将该医疗器械审批为Ⅱ类。
为明晰麻醉深度监护仪的管理类别,我们从《医疗器械分类规则》入手进行分析。
麻醉深度监护仪属于有源接触人体医疗器械,根据《医疗器械分类规则》附件《医疗器械分类判定表》,有源接触人体医疗器械中的“诊断监护器械”使用状态 “轻微损伤”“中度损伤”的管理类别为“Ⅱ”,使用状态“严重损伤”的管理类别为“Ⅲ”。麻醉深度监护仪是用于麻醉状态的评估,通过测量相应数据如量化麻醉意识水平的AAI数值,给出麻醉状态结论,或提供相应数据供医生判断患者麻醉的状态。麻醉状态的判断对于手术中的患者来说至关重要,如麻醉状态判断不准,可能会出现导致患者麻醉过深而死亡的风险,所以麻醉深度监测仪使用状态应为 “严重损伤”,从风险管控的角度来说,麻醉深度监护仪应当判定管理类别为“Ⅲ”。
建议
通过以上分析,笔者认为:第一,麻醉深度监护仪管理类别应当为Ⅲ类。根据《医疗器械监督管理条例》第六条、第二十三条规定,国家药品监督管理局对企业申请类别确认进行确定类别,是有据有理的合法行为,具体负责类别确定的医疗器械标准管理中心出具的类别确认意见是权威的、决定性的。而《关于公布新修订免于进行临床试验医疗器械目录的通告》只是对免于进行临床试验医疗器械目录的列举,并不具备对医疗器械分类界定的功能,医疗器械的分类界定也不以其为准。
第二,明确麻醉深度监护仪与多参数监护仪[特指脑电(EEG)波形监护]之间的异同。多参数监护仪[特指脑电(EEG)波形监护]仅采集、显示和贮存患者的脑电波,可以提供给医生判断包括麻醉深度在内的临床结论;而麻醉深度监护仪不仅采集、显示、贮存患者的脑电波,而且将采集到的脑电波经主机运算处理后,得出麻醉深度指数数值,等同于由机器判断患者麻醉深度,并将结果告知医生。
目前有两个亟待解决的问题:
一是在2019年《2018年医疗器械产品分类界定结果汇总》发布,明确麻醉深度监护仪为Ⅲ类医疗器械之后,我国共有8个产品注册,除浙江一洋医疗科技有限公司在2020年3月13日在国家药监局取得了Ⅲ类医疗器械注册证外,其他7个产品均按Ⅱ类医疗器械在企业所在省、直辖市取得了产品注册证。在对《医疗器械分类目录》未明确列明的医疗器械类别确定后,各省、自治区、直辖市应该认真学习理解,特别是负责医疗器械审批的部门,以保证我国对同一种医疗器械,执行同一管理类别。如有条件,可以建立相应数据库,不管是企业还是审批部门,将医疗器械名称输入即可查询出其最新的管理类别,这样就可以从技术上保证同一医疗器械执行同一管理类别。
二是目前根据《关于公布新修订免于进行临床试验医疗器械目录的通告》,企业申请包含“麻醉深度外接配件”,且用于“麻醉深度指数监测用”的产品“多参数监护仪”,是按Ⅱ类进行管理的。但究其本质,此时注册的“多参数监护仪”是包含了麻醉深度监护仪的功能的,由此可见企业目前可以合理合法地“变通”注册Ⅱ类“麻醉深度监护仪”,只是产品名称只能为“多参数监护仪”,而不能是“麻醉深度监护仪”,但其实质和内涵可以完全一样。(江西省景德镇市市场监督管理局 王张明)
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐
-

剖析法条明要素 靶向发力寻证据 ——浅析证明对象在药品行政处罚中的应用
如何运用证明对象的概念指导药品行政执法部门正确收集证据、认定案件事实并准确适用法律呢?笔者认为,可分解法律条文中规定的药品违法行为的构成要件,明确各构成要素,并将这些要素作为证明对... 2025-12-16 08:45 -

企业捐赠的医疗器械质量不合格,如何处罚?
A省药监局查处一起医疗器械生产企业生产的医用外科口罩不符合强制性标准案。该案中,B企业生产的不合格产品一部分用于销售,另有70%的产品捐赠至社会单位。 这并非个案。此类案件争议的焦点集中... 2025-12-16 08:50
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有