GVP逐条谈 | 81.数据这么多,定期安全性更新报告该选哪个?
- 2021-09-15 16:56
- 作者: 马明媛
- 来源:中国食品药品网
【条文】
《药物警戒质量管理规范》第五章 风险识别与评估
第四节 定期安全性更新报告
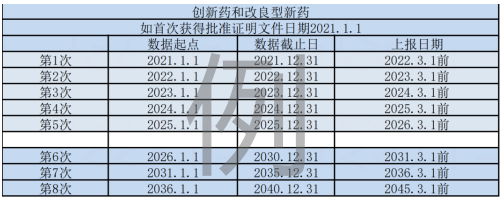
第八十一条 定期安全性更新报告的数据汇总时间以首次取得药品批准证明文件的日期为起点计,也可以该药物全球首个获得上市批准日期(即国际诞生日)为起点计。定期安全性更新报告数据覆盖期应当保持完整性和连续性。
【理解】
第八十一条规定了定期安全性更新报告(PSUR报告)的数据起始点。
PSUR报告的目的,是定期地用科学的方法,及时可持续地评价上市药品的安全性,通过采取针对性的风险控制措施达到药品使用安全的目的。因此PSUR报告数据覆盖期应当保持完整性和连续性。
·PSUR报告的报告期确定
首次提交:首次取得药品批准证明文件的日期或全球首个获得上市批准日期——数据截止日。
非首次提交:两次定期安全性更新报告数据截止日之间的时间段。
《药品定期安全性更新报告撰写规范》中规定:PSUR报告的数据汇总时间以取得药品批准证明文件的日期为起点计,上报日期应当在数据截止日后60日内。可以提交以国际诞生日为起点计的《定期安全性更新报告》,但如果上述报告的数据截止日早于我国要求的截止日期,应当补充这段时期的数据并进行分析。
·同一活性成份药品有多个批准证明文件时,怎样提交PSUR报告?
对于同一活性成份药品有多个批准证明文件(涵盖不同给药途径、适应症/功能主治或目标用药人群等),药品生产企业可以按照一个批准证明文件提交一份PSUR报告;也可以遵循化学药和生物制品按照相同活性成分、中成药按照相同处方组成在一份PSUR中进行报告。
以多个批准证明文件中最早的批准时间作为汇总数据最初的起始时间、按照最严格的时限要求报告,但需要根据药物的不同给药途径、适应症(功能主治)或目标用药人群等因素进行分层。
例如,某药品生产企业在2011年1月25日获得一个片剂的批准证明文件,在2014年9月7日又获得相同活性成分注射剂的批准证明文件。该企业在提交PSUR时有2种选择:
1. 根据批准证明文件分别提交。
对于这个例子中的片剂,药品生产企业应当以2012年1月24日为数据截止日提交PSUR,以后每年提交一次PSUR,直至首次再注册;之后每5年报告一次。对于这个例子中的注射剂,药品生产企业应当以2015年9月6日为数据截止日提交PSUR,以后每年提交一次PSUR,直至首次再注册;之后每5年报告一次。
2. 根据同一活性成分提交一份PSUR。
对于这个例子中的片剂,药品生产企业应当以2012年1月24日、2013年1月24日、2014年1月24日为数据截止日提交PSUR。2014年9月7日同种活性成分的注射剂获批。对于该产品,药品生产企业应当以2015年1月24日为数据截止日提交PSUR,以后每年提交一次PSUR,直至该注射剂首次再注册;之后每5年报告一次。
【实践影响】
持有人需要先确定好正确的数据起始点,才能保证定期安全性更新报告数据覆盖期的完整性和连续性。
【延伸阅读】
《药品定期安全性更新报告撰写规范》(浙江太美医疗科技股份有限公司医学专员 马明媛)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐
-

剖析法条明要素 靶向发力寻证据 ——浅析证明对象在药品行政处罚中的应用
如何运用证明对象的概念指导药品行政执法部门正确收集证据、认定案件事实并准确适用法律呢?笔者认为,可分解法律条文中规定的药品违法行为的构成要件,明确各构成要素,并将这些要素作为证明对... 2025-12-16 08:45 -

企业捐赠的医疗器械质量不合格,如何处罚?
A省药监局查处一起医疗器械生产企业生产的医用外科口罩不符合强制性标准案。该案中,B企业生产的不合格产品一部分用于销售,另有70%的产品捐赠至社会单位。 这并非个案。此类案件争议的焦点集中... 2025-12-16 08:50
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有