一文读懂医疗器械许可事项变更
- 2021-09-28 09:09
- 作者:
- 来源: 中国食品药品网
依据《医疗器械注册与备案管理办法》,已注册的第二类、第三类医疗器械产品,其注册证载明的相关事项发生变化,注册人应当向原注册部门申请办理变更注册手续或备案。其中,注册证载明的产品名称、型号、规格、结构及组成、适用范围、产品技术要求、进口医疗器械的生产地址等变化需要办理变更注册(也称为许可事项变更);注册人名称和住所、代理人名称和住所等发生变化需要申请备案(也称为登记事项变更)。
本文结合法规要求并配合相应的案例分析,重点介绍如何判断应进行哪些内容的许可事项变更、应如何判断是否需要进行补充检测、是否需要进行临床评价等企业关注的问题。
医疗器械许可事项变更类型判定
根据原国家食品药品监督管理总局《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(以下简称《公告》),医疗器械许可事项变更根据变更内容的不同在申报资料的要求上有所不同。当产品发生了下列变化时,需要进行许可事项变更:(一)产品名称变化;(二)产品技术要求变化;(三)型号、规格变化;(四)结构及组成变化;(五)产品适用范围变化;(六)进口医疗器械生产地址变化;(七)注册证中“其他内容”变化;(八)其他变化。
对于医疗器械的许可事项变更,通常需要找到一个变化的“根源”,即变化的原始因素。例如,通常产品技术要求并不会主动发生变化,都是由于产品的变化,或者其他变化引起了技术要求的变化。这种情况下,需要根据产品或者企业想要的结果的变化,去考虑上述变化内容中的变化情况,最后来确定相应的变化事项。下面根据两个案例来分析变更项目。
案例1:某产品的随机软件进行了版本升级,升级后产品的名称及适用范围不变。那么在许可事项变更申请的时候,应当申请哪些变更呢?
首先需要考虑的是如何进行变更的规划,如果企业原有版本还想继续保留,建议以增加型号的方式来进行许可事项变更。那么涉及到的变化有“型号、规格变化”;“结构及组成变化”(一般产品结构组成中需明确随机软件的版本,则该变更会涉及到注册证中结构组成描述的变化)以及“产品技术要求变化”这三个方面。因此需要以这三个变化项目去准备资料。
如果原有软件版本已不再使用,则可以在原有规格型号的基础上进行变更,即规格型号不变化。那么涉及到的变化有“结构及组成变化”(一般产品结构组成中需明确随机软件的版本,则该变更会涉及到注册证中结构组成描述的变化)以及“产品技术要求变化”这两个方面。因此需要以这两个变化项目去准备资料。
案例2:某胰岛素注射针企业想要将产品适用范围扩充到能配合多个已上市注射笔,并能注射多种药物。但是产品本身未发生变化。
以上产品本身未发生变化,但是发生了适用范围的变化,由于原产品名称为“一次性使用胰岛素笔配套用针”,发生变化后,原产品名称已不适用,因此本次发生了“产品名称变化”“产品技术要求变化”和“产品适用范围变化”。
因此,对于医疗器械产品的许可事项变更,应根据产品或企业期望的变化结果,结合《公告》中关于变更事项的内容进行确定。
医疗器械许可事项变更之所需研究资料(临床评价)
当已经判断好需要进行的许可事项变更内容后,依据《公告》中“七、变化部分对产品安全性、有效性影响的资料,分析并说明变化部分对产品安全性、有效性的影响,并提供相关的研究资料。适用范围变化的必须提供临床评价资料。”
根据上述要求,在产品申请许可事项变更时,需根据变更内容提供相应的变化部分的安全性、有效性的研究资料。那么研究资料具体包含哪些呢?
根据《公告》关于首次注册的资料描述,研究资料包含“产品性能研究”“生物相容性评价研究”“生物安全性研究”“灭菌/消毒工艺研究”“产品有效期和包装研究”“临床前动物试验”“软件研究”和“其他资料”八个部分;企业可以根据发生变化的内容对上述研究进行选择,具体选择方式以上文的例子来说,若设备发生了软件升级,并且是以增加型号的方式来发生变更,那么针对该变化,新型号需要提供上述资料中任何一个适用的研究资料。当然,性能研究可能可以只对两个规格型号差异的部分进行研究,或者对于有效期研究,可以认为新型号与原型号在影响寿命的因素选取方面是一致的,因此原型号的寿命研究报告可以覆盖本次增加的型号等。因此,对于研究资料来说,哪怕不再提供新的研究报告,也应当对该方面的研究进行评价,以确认该部分不需要重新进行研究。对于软件部分的研究,是本次变更的重点,应当根于《医疗器械软件注册审查指导原则》中的要求就软件更新的内容进行研究,并提供相应资料。
同时,针对任何产品发生变化,都应重新进行风险评估,即需要重新提供风险管理资料。
关于临床评价部分,《公告》明确与适用范围相关的变更应当进行临床评价。但综合来看,一般认为以下几种情况,应该考虑临床评价:1)增加新的规格型号;2)产品技术指标变化后可能影响到临床使用的,例如性能指标变差了或者改变/增加了原有功能等,且应注意各技术指标之间可能存在互相制约互相影响的情况;3)结构组成发生变化后可能影响技术指标或功能的;4)软件版本发生变化的,根据《医疗器械软件注册审查指导原则》,软件更新描述文档中明确有临床评价要求;5)适用范围变化;6)其他情况需要具体评估。
医疗器械许可事项变更之检测要求
当已经确定好需要进行的许可事项变更内容后,依据《公告》“八、针对产品技术要求变化部分的注册检验报告”,技术要求发生变化的,均应进行检测。具体检测内容可根据变化部分的影响来评估。
但是从注册实际操作来说,可能遇到三种情况,一种是产品变了,但是技术要求不变;第二种是产品不变,但是技术要求变了;最后一种是产品和技术要求都变了。这里的“产品变化”是指产品自身的任何硬件与软件。
根据法规,上述第三种情况,毫无疑问,肯定要补充检测;而对于第二种情况,一般情况下都要进行补充检测,除非有证据能证明产品能符合新的技术指标,证明方式可以是以前的检测报告等,若原检测报告中包含了检测数据,该数据能证明产品是符合新的技术指标的。对于第一种情况,就是产品技术要求中的内容,是没有任何变化的,但是产品实际发生了变化,仍然应当对变化部分涉及的性能指标进行检测。
是否只要发生了变化,就应当进行全性能检测呢?答案是“否”。如何判定应当检测哪些项目呢?以下原则供参考:1)对于无源产品,如变更的主要零部件的主要材料,那么在排除是否应为另一注册单元的情况下,补检与变更部件相关的任一性能指标。2)对于无源产品,如变更的是主体结构的结构设计,那么需根据变化情况,补检与变更部件相关的任一性能指标。若整个技术要求的内容涉及的条款以及检测费用不是太高,那么全性能检测也无妨。3)对于有源产品,若产品本身发生了元器件的变化,那么应当根据元器件涉及的性能部分进行补检,安规部分应进行充分评估,确定影响的相关条款进行补充检测。4)对于有源产品,若发生了任意带电零部件的变化,均应进行EMC(电磁兼容)的检测。
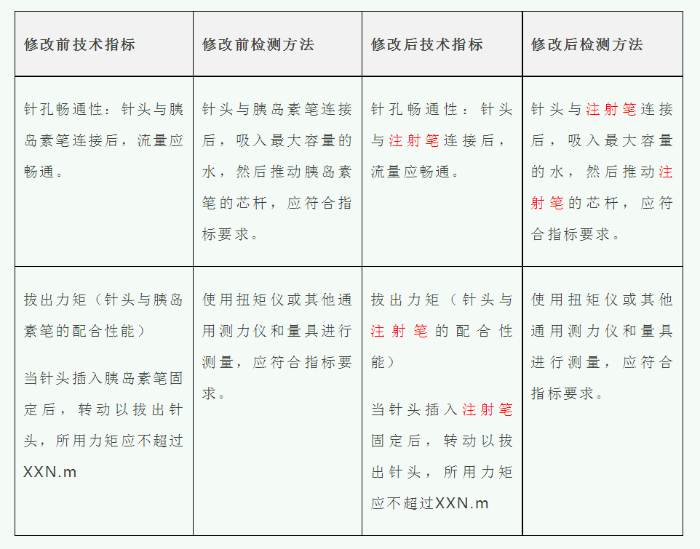
案例3:某胰岛素注射针企业想要将产品适用范围扩充到能配合多个已上市注射笔,并能注射多种药物。但是产品本身未发生变化。
从上述描述可以看出,产品技术要求中与注射笔配合的条款将会发生变化,相应配合检测注射笔也会发生变化(变化见表1)。基于指标的变化,应当对上述条款进行补充检测。其余条款均仅涉及产品本身,因此其余条款可以不进行补检。
表1
(瑞旭集团-北京西尔思科技有限公司供稿)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:辛悦然)
分享至
右键点击另存二维码!
-
为你推荐