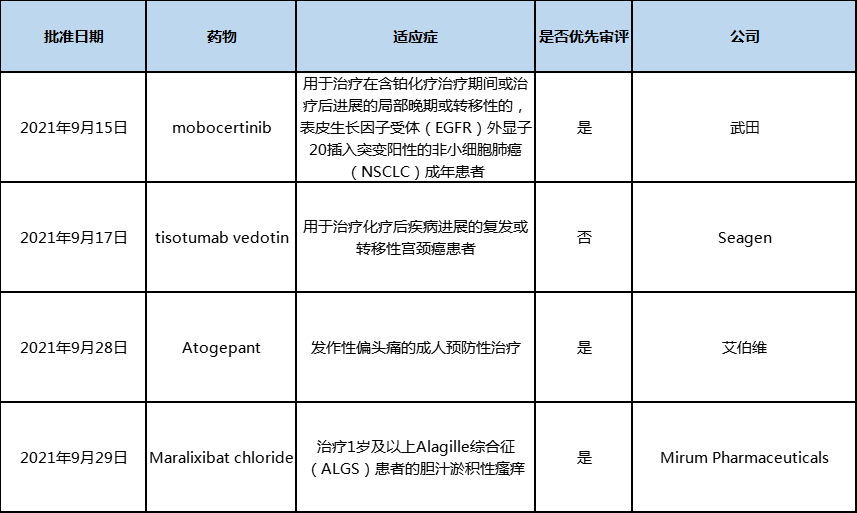
数据|2021年9月中美欧批准上市的新药
- 2021-10-09 13:51
- 作者:陈倩
- 来源:中国食品药品网
2021年9月,中美欧批准上市的新药数量都有所减少,其中美国批准4款新药,中国批准1款,欧盟没有新批准的新药。
美国
2021年9月,美国批准上市4款新药,多数通过加速批准获批。根据Pharmadigger数据库,均为全球首批。
表1 2021年9月美国批准上市的新药
Mobocertinib获得了美国FDA优先审评、突破性治疗、快速通道指定和孤儿药认定等四项资格,是第一个被批准的专门针对EGFR Exon20插入突变的口服治疗药物。该药的批准是基于I/II期临床试验结果,试验共入组114名之前接受过铂类药物治疗的EGFRExon20插入或转移性非小细胞肺癌(NSCLC)患者,试验中患者口服mobocertinib 160mg/每日1次,直到疾病进展或出现不可接受的毒性。2021年ASCO年会上公布的结果为独立审查委员会(IRC)评估的总体反应率(ORR)为28%(研究者评估的ORR为35%),中位应答持续时间(DOR)为17.5个月,中位总生存期(OS)为24个月,中位无进展生存期(PFS)为7.3个月。2020年10月,mobocertinib在中国获得突破性治疗认定,2021年7月7日,mobocertinib的中国上市申请(NDA)获得国家药监局受理。
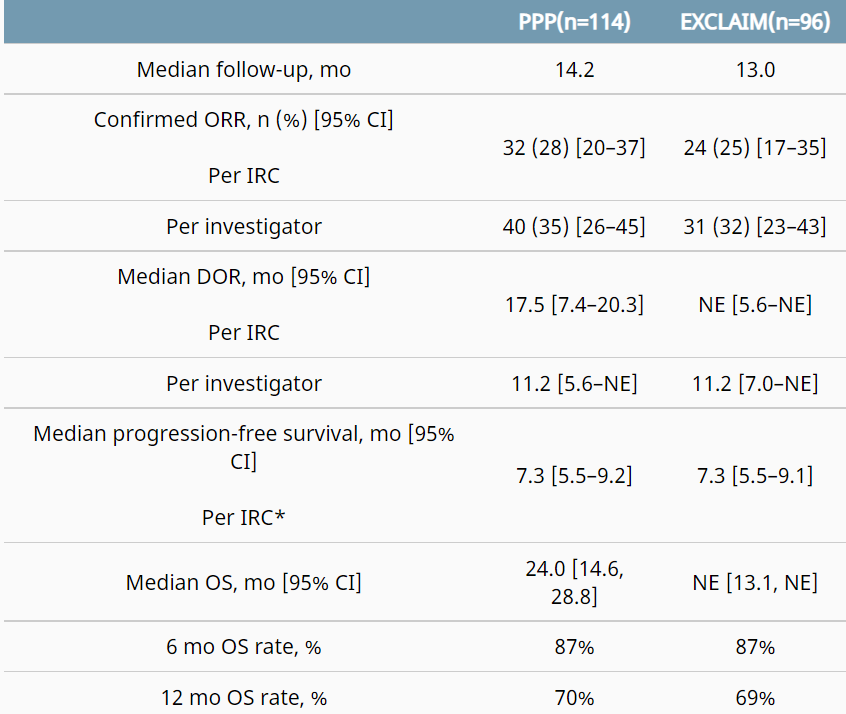
图 Mobocertinib试验和EXCLAIM试验有效性结果
Tisotumab vedotin的批准基于关键II期innovaTV 204研究的结果。结果显示,tisotumab vedotin治疗的ORR为24%(95%CI:15.9%-33.3%),其中完全缓解率(CR)为7%(7例),部分缓解率(PR)为17%(17例)。中位DOR为8.3个月(95%CI:4.2-未达到);中位PFS为4.2个月(95%CI:3.0-4.4),6个月PFS率为30%(95%CI:20.8-40.1);中位OS为12.1个月(95%CI:9.6-13.9),6个月OS率为79%(95%CI:69.3-85.6)。
Tisotumab vedotin最常见的治疗相关不良事件(≥20%)包括脱发、鼻出血、恶心、结膜炎、疲劳、干眼症。
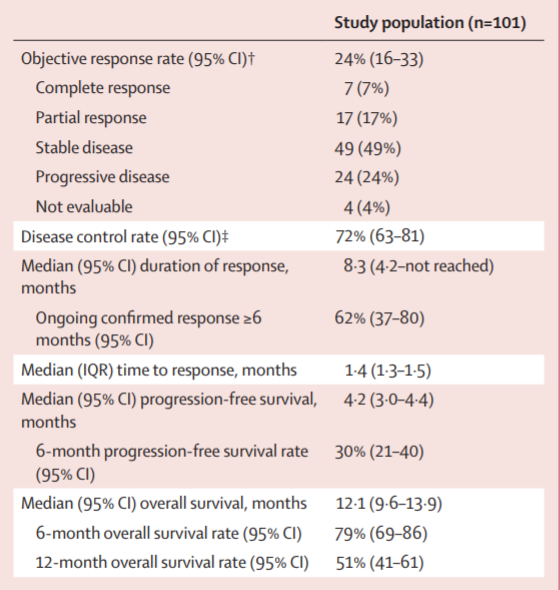
图 innovaTV 204有效性结果
Atogepant是降钙素基因相关肽 (CGRP) 受体拮抗剂,在偏头痛发作期间CGRP水平升高。Atogepant是目前第一个也是唯一一个预防性治疗偏头痛的口服CGRP受体拮抗剂。此次批准基于包括关键III期试验ADVANCE研究在内的多个试验数据,涉及患者人数超过2000人。在名为ADVANCEDE的试验中,所有Atogepant的积极治疗组均达到了其主要终点,即在12周治疗期间,与安慰剂相比,所有剂量(10mg、30mg、60mg)Atogepant将每月平均偏头痛天数从基线水平在统计学上显著降低。此外,2种高剂量(30mg、60mg)在全部6个次要终点方面均显示统计学上的显著改善,具有统计学意义。Atogepant在2019年6月也向中国申请了IND。

图 ADVANCE研究有效性结果
Maralixibat chloride是一种口服顶端钠依赖性胆汁酸转运体(ASBT)抑制剂,导致更多胆汁酸从粪便中排除,减少胆汁酸介导的肝损伤和并发症。该药是用于治疗这一罕见肝脏疾病的首款FDA获批疗法。Maralixibat chloride的批准是基于名为ICONIC的关键性IIb期临床试验的结果。试验结果显示,与安慰剂相比,接受Maralixibat chloride治疗的患者瘙痒症状显著减少并且维持4年。
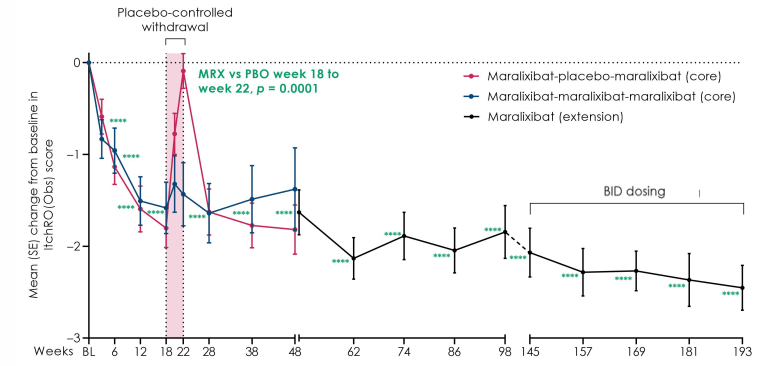
图 ICONIC试验瘙痒结果
2021年5月Mirum制药和北海康成宣布,双方已签订许可协议,授权北海康成在大中华区对Maralixibat进行开发和商业化,期待这一款新药早日在中国上市。
中国
中国在2021年9月批准了1款新药,且为中国自主研发的新药。
表2 2021年9月中国批准上市的新药
瑞基仑赛注射液(研发代号:JWCAR029 )是在美国Juno公司JCAR017基础上,由药明巨诺自主开发的CAR-T产品。该药获批是基于一项单臂、多中心、关键性研究(RELIANCE研究)。研究结果显示,可评估有效性的58例中国复发或难治性大B细胞淋巴瘤(r/r LBCL)患者的最佳客观缓解率为75.9%(95% CI,62.8~86.1),最佳完全缓解率为51.7%(95% CI,38.2~ 65.1)。中位随访时间8.9个月,未达到中位OS,6个月DOR、PFS和OS分别为60.0%、54.2%和90.8%。
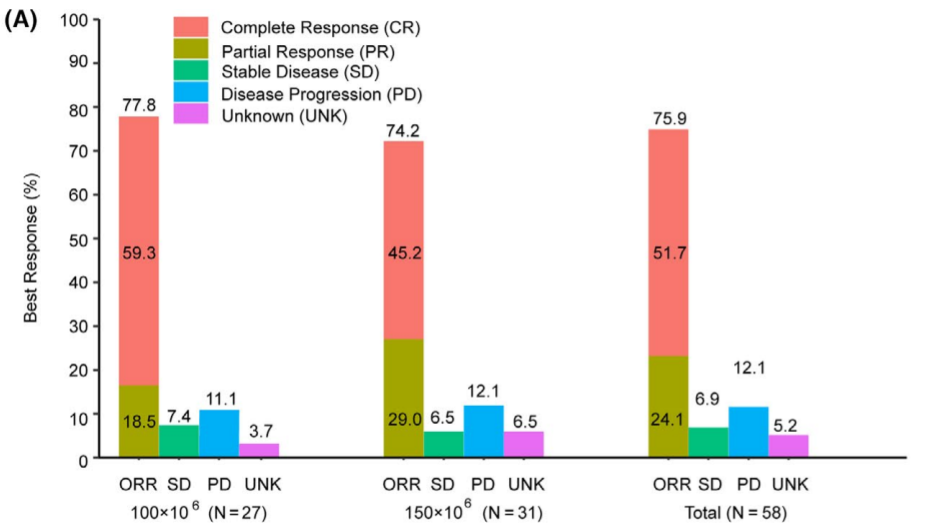
图 RELIANCE研究有效性结果
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐












