治疗新冠特效药物研发大盘点 全球有研发进展数量超百余种
- 2021-11-23 20:06
- 作者:付佳
- 来源:中国食品药品网
中国食品药品网讯 COVID-19全球流行已近两年时间,对人类健康与经济发展造成了重大影响。在全力推进新冠病毒疫苗研发的同时,全球制药业也正全力推进针对COVID-19的各类治疗性药物的研发工作,取得了一系列进展。公开资料显示,全球有研发进展的新冠病毒治疗药物数量超百余种。本文对部分新冠病毒治疗药物进行简单盘点。
多款中和抗体药物已获EUA
中和抗体可以和病毒颗粒结合,阻止病毒感染细胞。简单来说,中和抗体是特异针对病毒中和表位产生的抗体,可直接靶定到病毒中和表位,使病毒失去结合受体的能力,具有“中和”病毒的作用。中和抗体是康复患者血浆中抗病毒最有效的成分,是可能在短时间落地治疗和预防新冠的有效的特效药,具有特异性强、副作用相对较小,疗效确切性强的优势。
国外中和抗体项目
美国再生元公司研发的REGN-COV2(casirivimab和imdevimab组合)鸡尾酒疗法已于2020年10月获FDA紧急授权使用(EUA)。
美国礼来与中国君实生物联手研发的LY-CoV555(bamlanivimab)和JS016(etesevimab)组合疗法已于2021年2月在美紧急使用授权范围扩大,新增用于特定人群的暴露后预防(PEP)以防止新型冠状病毒(SARS-CoV-2)感染。
美国VIR Biotechnology与英国葛兰素史克公司联合开发的VIR-7831已于2021年5月获得FDA的紧急使用授权(EUA),用于治疗轻度至中度COVID-19成人和儿科患者。
英国阿斯利康公司研发的AZD7442于2021年10月公布III期临床试验结果,并于10月5日,向美国FDA提交AZD7442预防新冠肺炎的紧急使用授权申请。
另外,新加坡Tychan公司研发的TY027已于2020年5月完成I期临床试验,目前正在进行III期临床试验。韩国Celtrion公司研发的CT-P59于2021年2月获得韩国MFDS的全面核准,用于治疗COVID-19患者。
国内中和抗体项目
君实生物和中科院微生物所联合开发的JS016目前正在积极推进III期临床试验,JS016与另一中和抗体联合使用已获得全球15个国家紧急使用授权(见上文)。
清华大学、深圳市第三人民医院和腾盛华创联合研发的BRII-196和BRII-198在今年8月公布了III期临床中期分析结果,并已应用于700余例患者的救治中。2021年10月,腾盛华创已向国家药监局滚动提交附条件上市申报材料。
神州细胞研发的SCTA01已于2020年9月完成I期临床试验。目前,SCTA01已获准在美国、巴西、墨西哥等国家开展II期、III期临床研究,临床入组正在进行中。
此外,还有北京大学谢晓亮团队与丹序生物联合开发的DXP-604目前正在开展国内II期临床试验,丹序已与国药集团中国生物接洽,推进海外II期、III期临床试验。同时,DXP-604已经被批准在北京地坛医院作为同情紧急治疗用药,已有14名新冠患者接受了治疗。
新冠中和抗体治疗新冠具有重要作用,具有较大发展潜力。具有中和活性的单克隆抗体具有靶点明确、纯度高以及可大规模制备等优势,并且已有多种单克隆抗体制剂用于病毒性传染病防治的经验,单克隆抗体或可成为对抗新冠病毒的有力武器。从各大制药公司公布的已有的II、III期临床试验结果以及批准EUA的中和抗体的治疗效果均表明中和抗体在治疗新冠患者中的有效疗效。我国JS016、BRII-196、BRIII-198和SCTA01的研制进展迅速,均已进入临床试验阶段,具有巨大的发展潜力。
小分子药物
与疫苗及中和抗体相比,口服小分子药物具有给药方便、储存简单、生产工艺成熟的多方面优点,是对抗新冠肺炎疫情必不可少的药物组合之一。在研发人员寻找新冠的小分子特效药过程中,发现了多种不同类型的药物,如RNA合成酶抑制剂、AR拮抗剂、JAK抑制剂、3CL蛋白酶抑制剂、抗生素等。部分小分子药物已获批用于COVID-19的治疗,还有许多小分子药物已进入COVID-19的临床试验。
瑞德西韦是由美国吉利德科学公司开发的一种新型广谱抗病毒药物,于2020年10月,在美获批用于治疗12岁及以上、体重至少达到40公斤且需住院的新冠患者,也是目前唯一获FDA批准上市的新冠小分子药物。目前,瑞德西韦还在50多个国家获得了紧急使用的授权,包括欧盟、日本、新加坡、印度等。
法匹拉韦(Favipiravir)是由日本富山大学医学部与富山化学(今富士胶片富山化学)共同研发的一种广谱抗RNA病毒药物。2021年9月,俄罗斯、印度、匈牙利已经批准法匹拉韦用于新冠的临床治疗。
莫努匹韦(Molnupiravir)是由美国埃默里大学研发的一款核糖核苷类似物的前药,能够在病毒RNA复制过程中替换核糖核苷而引起基因突变并由此抑制多种RNA病毒的复制。2021年10月,默沙东宣布了该药物最新的优异的III期数据;随后,向FDA提交在紧急状况下使用的新药申请。2021年11月,英国药品和健康产品管理局宣布批准上市。成为全球首个获批的口服治疗COVID-19的抗病毒药物。
巴瑞替尼(Baricitinib)是由美国Incyte制药公司研制、由礼来公司负责全球开发与销售的一款用于治疗类风湿关节炎的药物,其通过抑制JAK1/2调节炎症和免疫相关的信号通路,从而缓解自身免疫性疾病。基于巴瑞替尼良好的抗炎作用,它被用于缓解新冠引起的过度炎症反应。美国FDA于2020年11月批准了巴瑞替尼与瑞德西韦针对新冠的联合用药紧急使用,用于治疗2岁及以上需要辅助呼吸的患者;在2021年7月,FDA调整了以上方案,巴瑞替尼可单独紧急使用治疗上述新冠患者。
普克鲁胺(Proxalutamide)是由中国开拓药业研发的一款雄激素受体(AR)拮抗剂,该药物能能够阻断雄激素受体信号。2021年7月,普克鲁胺获得了巴拉圭的紧急使用授权,用于新冠住院患者的治疗。2021年5月,FDA批准了普克鲁胺治疗住院患者的III期临床试验,并批准在已开展的门诊患者III期试验中纳入女性患者;2021年9月,国家药监局批准了普克鲁胺治疗轻中度男性患者、重症住院患者的两项全球多中心临床试验。
Paxlovid(PF-07321332和利托那韦)是美国辉瑞研发的一款针对新冠病毒3CLpro蛋白酶(或称Mpro蛋白酶)的口服抑制剂。3CLpro蛋白酶通过水解多聚蛋白体释放具有活性的病毒蛋白,在冠状病毒中高度保守且人体内无类似蛋白酶,是理想的治疗靶点。PF-07321332与低剂量利托那韦(ritonavir,逆转录病毒抑制剂、HIV常用治疗药)联用,能够降低代谢速率、维持较高的血药浓度,最终达到较长时间的治疗效果。2021年11月,已向FDA递交新冠口服药Paxlovid(PF-07321332+利托那韦)的紧急授权申请(EUA)。同时,辉瑞表示已经向包括英国、澳大利亚、韩国在内的多个国家开始滚动提交上市申请。
另外,针对3CLpro靶点,日本盐野义公司的口服抑制剂S217622于2021年9月27日在日本开启了II/III期临床试验。
此外,中国前沿生物的FB2001经FDA批准正在美国进行I期临床试验。济民可信研发的JMB-2002已于2021年9月完成I临床试验。中科院上海药物研究所、中科院武汉病毒研究所和中科院新疆理化技术研究所等国内多家科研机构共同研制的VV116于2021年11月首先在乌兹别克斯坦获准开展临床试验,该临床试验I期、II期、III期同时开展,而国内的临床试验也在进行。真实生物的抗HIV药物阿兹夫定已于2020年4月获国家药监局批准进行III期临床试验,用于治疗新冠肺炎。杰华生物的乐复能(重组细胞因子基因衍生蛋白注射液)于2021年11月公布III期临床试验第一阶段(Cohort A)数据总结。(数据来源:根据公开资料整理,整理日期截止到11月20日)(付佳)
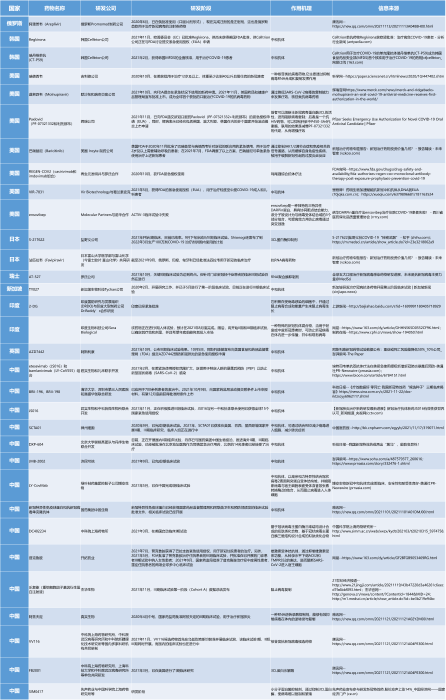
附件:表格--全球治疗新冠特效药物(部分)盘点(按国家首字母排序)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:宋佳薇)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐