我国罕见病药物研发蓄势待发
- 2021-12-24 16:09
- 作者:王宇恒
- 来源:中国食品药品网
12月21日,国家药监局通过优先审评审批程序批准罕见病治疗药品奥法妥木单抗注射液(英文名: Ofatumumab Injection)的进口注册申请,用于治疗成人复发型多发性硬化(RMS),包括临床孤立综合征、复发缓解型多发性硬化和活动性继发进展型多发性硬化。多发性硬化(MS)是免疫介导的慢性中枢神经系统疾病,已被纳入我国第一批罕见病目录。奥法妥木单抗注射液是一种抗人CD20的全人源免疫球蛋白G1单克隆抗体,靶向CD20分子,通过诱导B细胞溶解达到治疗作用。该品种的上市为患者提供了治疗选择。
罕见病药物研发过程充满挑战,患者数量少、对疾病发展史了解有限、已上市药物数量少,以及投入成本大、商业回报难预期等,都严重制约了罕见病药物的研发。近年来,随着技术的不断发展以及政策支持,全球越来越多的药企开始投身于罕见病药物的研发。
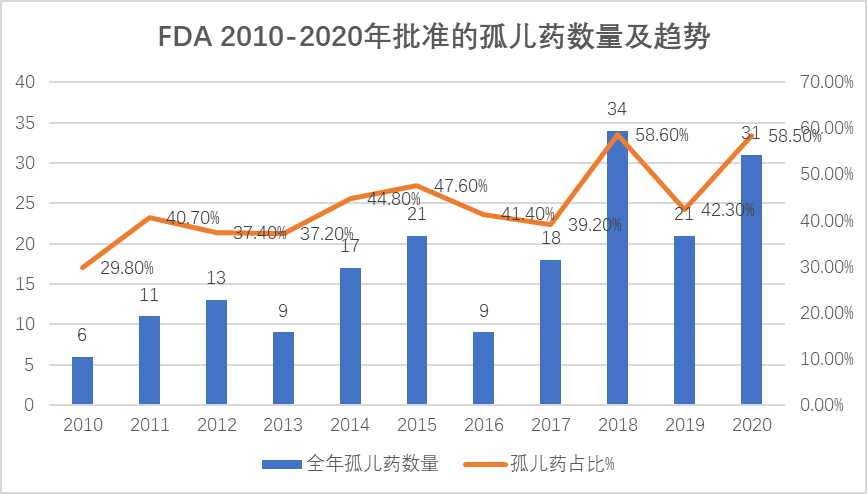
数据来源:美国FDA官网
在2010-2020年美国FDA批准的新药中,“孤儿药”数量呈稳步上升的趋势。2010年,FDA批准的孤儿药数量仅有6个,到2018年已达到34个。2020年FDA批准的孤儿药数量为31个,占全年获批新药总数的58.5%。除了数量的激增,研发成功率也在快速提升。最新发布的一份药物临床开发成功率报告显示,从2011年到2020年,孤儿药(不含肿瘤适应症)从Ⅰ期临床到获得美国FDA批准上市的平均成功率为17%,高于整体药物的平均开发成功率7.9%。
我国罕见病药物研发也是百舸争流。在近日召开的中国罕见病大会上,国家医保局副局长李滔指出,截至目前,国内共有60余种罕见病用药获批上市,其中已有40余种被纳入了国家医保目录,涉及25种疾病。
表1 近三年国家药监局批准的罕见病药物
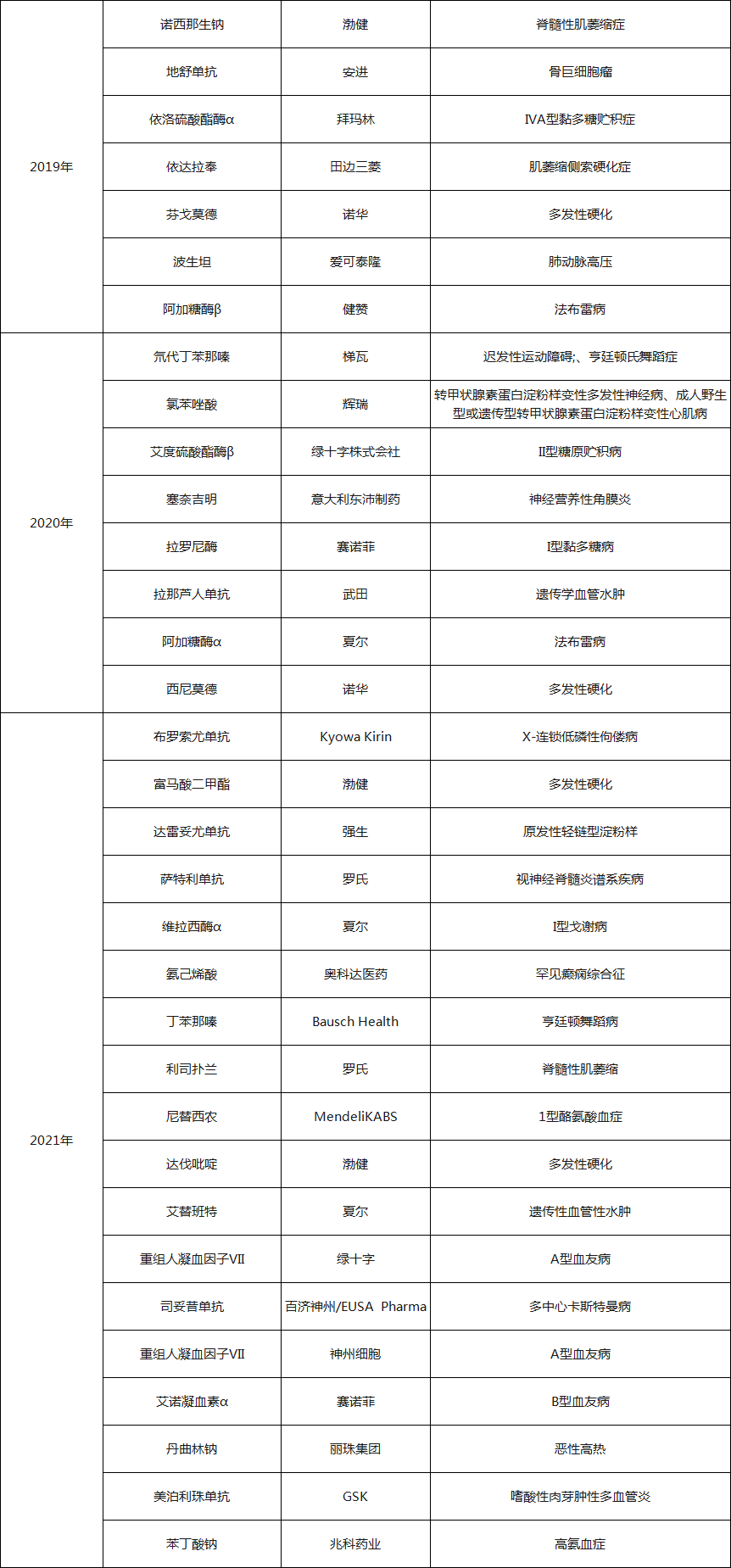
数据来源:药融云(不完全统计,其中2021年统计时间截至12月9日)
如本文开篇提到,除了有诺华等跨国药企有罕见病药物在中国上市,中国药企也有产品License-out。近日索元生物宣布,其License-out合作伙伴Aytu Biopharma收到美国FDA关于索元生物在研产品DB102用于治疗血管性埃勒斯-当洛综合征(VEDS)的关键性临床试验的IND批准,同时FDA授予DB102用于治疗VEDS的孤儿药资格。西比曼生物宣布,美国FDA已正式批准其核心产品C-CAR039的临床研究(IND)申请,将在美国推进后续的临床开发。C-CAR039是一款新型CD19/CD20双靶点CAR-T细胞治疗产品,拟开发用于治疗复发或难治性B细胞非霍奇金淋巴瘤(r/r B-cell NHL)。此前,FDA还曾授予C-CAR039孤儿药资格,用于治疗滤泡性淋巴瘤。
罕见病药物License-in更是佳音不断,2021年12月,琅钰集团与Rhythm Pharmaceuticals达成一项独家许可协议,获得后者罕见遗传性肥胖疾病药物Imcivree(setmelanotide)在中国内地、香港和澳门地区的开发和商业化权利。2021年3月,琅铧医药与Diurnal Group签订许可协议,获得后者儿童肾上腺皮质功能不全药物Alkindi在大中华区市场开发、注册和商业化的独家权利。2021年2月,畅溪制药与Aerami Therapeutics签署一项独家许可及产品开发协议,获得后者肺动脉高压候选药物AER-901在大中华地区的独家开发和商业化权利。兆科药业和丽珠集团已先于原研企业在国内取得苯丁酸钠颗粒和注射用丹曲林钠生产批件。
在国内还有北海康成、应诺医药、北京科信必成等专注于罕见病药物研发的企业,其中堪称国内罕见病药物先行者的北海康成已于今年12月10日在港交所上市。北海康成产品管线包含3个已上市产品,4个处于临床阶段的候选药物,1个处于临床准备阶段,2个处于临床前阶段,另外3个基因治疗专案处于先导识别阶段。CAN008是北海康成最核心的产品,这是一种正开发用于治疗多形性胶质母细胞瘤(GBM)的糖基化CD95-Fc融合蛋白,已于2021年4月获批在中国进行GBM患者一线Ⅱ期临床试验,并于同年10月完成首例患者给药。CAN103则是我国本土正在开发的针对戈谢病(GD)的ERT,是北海康成于2018年收购的首个罕见病药物。GD是一种溶酶体贮积病,是我国最知名的典型罕见病之一,2020年患病人数达约3000名。由于我国只有一种ERT药物获批准,故GD的有效治疗方法比较有限。此外,在北海康成已上市的3款产品中,Hunterase(CAN101)是该公司首款商业化罕见病产品,也是我国首个且唯一一个获批上市治疗MPSII(黏多糖贮积症II型)的ERT药物,已在全球超过10个国家获得临床验证及上市许可。
罕见病领域正在吸引越来越多的参与者和投资进入。波士顿咨询(BCG)研究称,2030年全球孤儿药市场规模预计达到1940亿美元。而中国,以占全球市场份额5%-7%来估算的话,2030年将形成一个600亿元-900亿元的市场。随着国家对罕见病药物研发的支持力度不断加大,罕见病用药研发已成为新药研发的主战场,相信不远的将来会有更多的药企推出更多罕见病用药,造福罕见病患者。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐












