每周医药看点(11.16—11.22)
- 2022-11-24 10:16
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 石家庄航空口岸被增设为药品进口口岸 ,《国家药品监督管理局药品审评中心 海南省药品监督管理局 海南博鳌乐城国际医疗旅游先行区管理局开展药品真实世界研究工作实施办法》发布,……11月16日—11月22日,医药行业的这些动态值得关注。
行业政策动态
1.国家药监局综合司、海关总署办公厅发布通知,增设石家庄航空口岸为药品进口口岸。自2022年11月22日起,除《药品进口管理办法》第十条规定的药品外,其他进口中药(不含中药材)、化学药品(包括麻醉药品、精神药品)可经由石家庄航空口岸(关区代码为0410)进口。
2.《国家药品监督管理局药品审评中心 海南省药品监督管理局 海南博鳌乐城国际医疗旅游先行区管理局开展药品真实世界研究工作实施办法》发布,进一步推进药品真实世界数据应用试点工作,建立顺畅的沟通协调机制。《实施办法》细化了三方职责、申报试点程序、沟通交流程序等,给予利好措施,同时明确了申请人退出试点的情形和程序。
3.国家药监局药品审评中心(CDE)就《与恶性肿瘤治疗相关中药新药复方制剂临床研发技术指导原则(征求意见稿)》公开征求意见。征求意见截止日期为2022年12月16日。中医药理论、人用经验和临床试验相结合(以下简称“三结合”)的中药注册审评证据体系为中药研发提供了新的路径。《指导原则》在“三结合”证据体系下,从基本原则、研发方向、人用经验研究和临床试验需要关注的问题等方面,重点阐述了中药复方制剂用于恶性肿瘤的临床应用现状、中医药理论以及对人用经验研究和临床试验的一般考虑,旨在为与恶性肿瘤治疗相关的中药新药临床研发提供建议和一般性方法学指导。
4.CDE就《特应性皮炎治疗药物临床试验技术指导原则(征求意见稿)》公开征求意见。《指导原则》根据2项美国食品药品管理局(FDA)发布的儿科特应性皮炎研发相关指导原则、中国特应性皮炎诊疗指南,以及在研药物的临床进展,对包括成人在内的特应性皮炎治疗药物进行了系统性的研发指导。征求意见截止日期为2022年12月17日。
5.CDE就《多发性硬化治疗药物临床试验设计技术指导原则(征求意见稿)》公开征求意见。《指导原则》旨在通过对多发性硬化不同治疗目标药物研发考虑因素以及临床试验设计关键要素的讨论,为多发性硬化治疗药物的临床研发和评价提供参考。征求意见截止日期为2022年12月17日。
6.CDE就《干眼治疗药物临床试验技术指导原则(征求意见稿)》公开征求意见。指导原则旨在通过讨论干眼治疗药物研发中临床试验设计需特别关注的内容,为干眼治疗药物的临床研发和评价提供参考。征求意见截止日期为2022年12月17日。
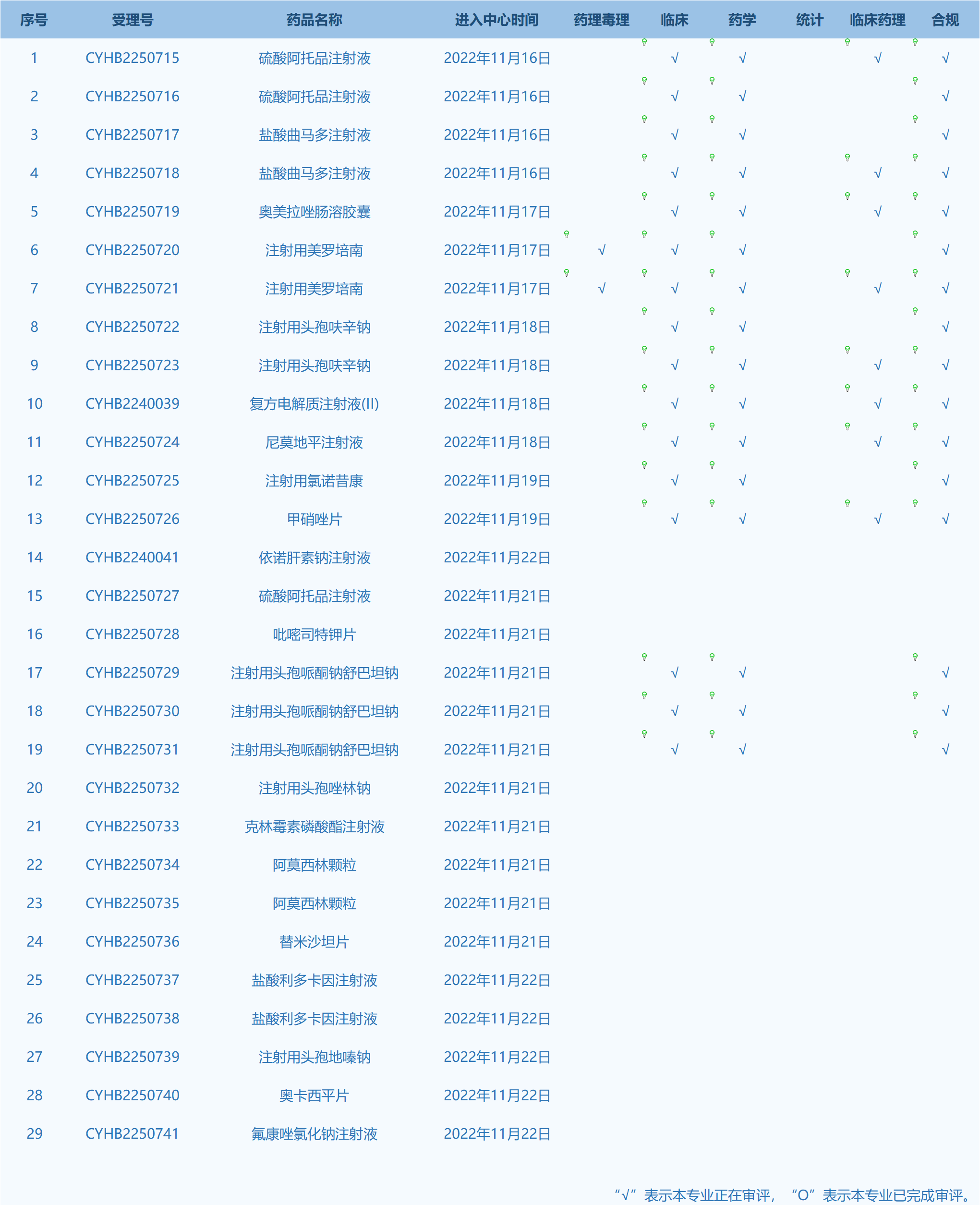
7.CDE网站公示29个仿制药一致性评价任务,涉及硫酸阿托品注射液等药品。(截至11月22日)
产品研发上市信息
1.国家药监局发布4期药品批准证明文件送达信息,共包括154个受理号,涉及辉瑞投资有限公司等企业。(截至11月22日)

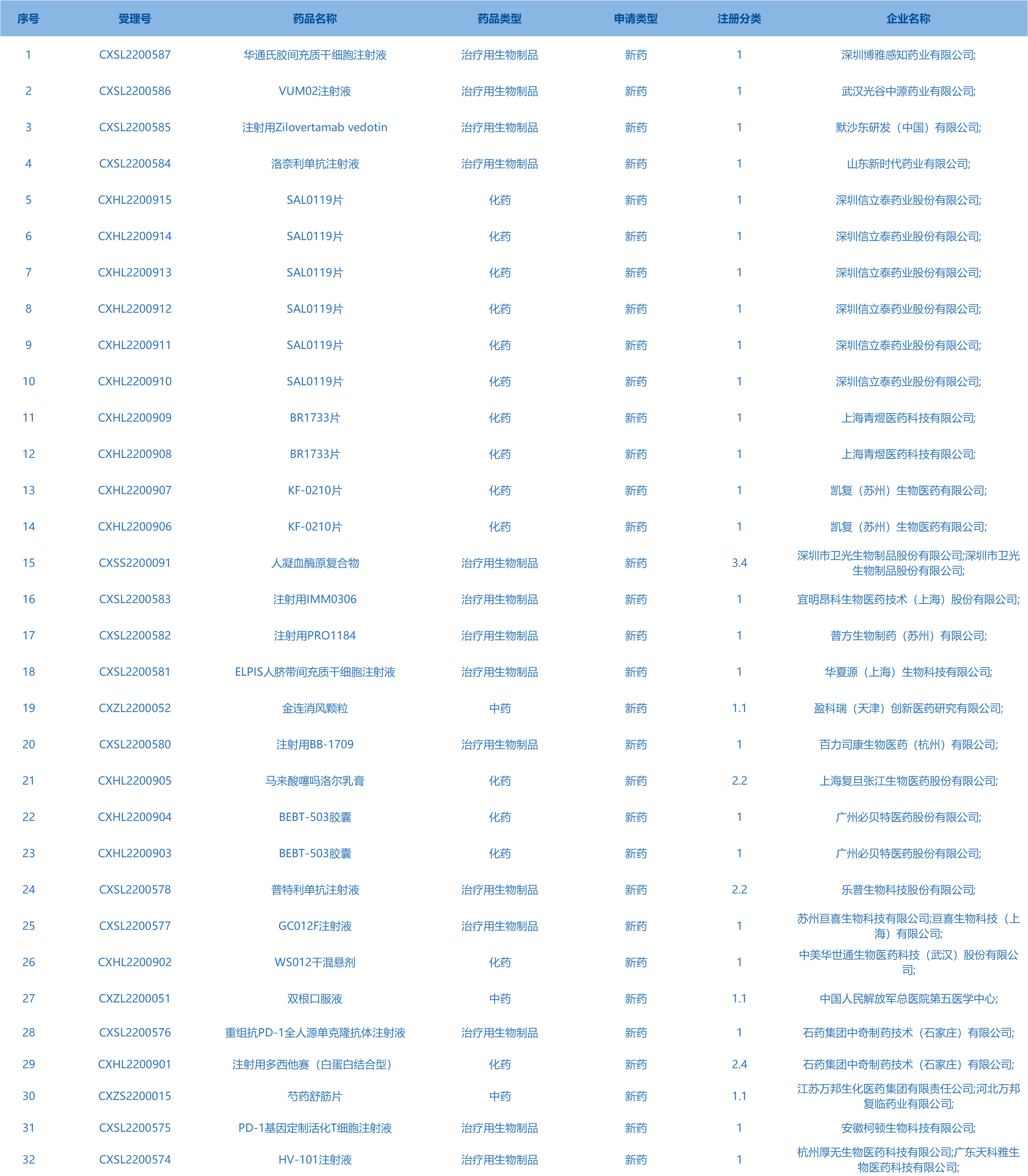
2.CDE承办受理32个新药上市申请,包括华通氏胶间充质干细胞注射液等药品。(截至11月22日)
3.翰宇药业发布公告称,其醋酸去氨加压素原料药收到欧洲药品质量管理局签发的欧洲药典适用性认证(CEP)证书。
4.普利制药发布公告称,收到加拿大卫生部签发的注射用盐酸万古霉素5g和10g的上市许可;收到芬兰国家药物署签发的注射用更昔洛韦的上市许可。
5.百济神州发布公告称,欧盟委员会已授予公司产品泽布替尼胶囊上市许可,批准其用于治疗初治(TN)或复发/难治性(R/R)慢性淋巴细胞白血病(CLL)成人患者。
6.迈威生物发布公告称,收到美国FDA签发的临床研究继续进行通知书,9MW3011的新药临床试验申请正式获得批准。
7.恒瑞医药发布公告称,其向美国FDA申报的钆布醇注射液新药简略申请(ANDA)已获得批准。
8.奥赛康药业发布公告称,其子公司AskGene收到美国FDA下发的注射用ASKG915临床试验申请受理通知书。
9.舒泰神发布公告称,收到美国FDA的通知邮件,同意STSA-1002皮下注射液关于ANCA相关性血管炎适应症开展临床试验。
10.华东医药发布公告称,其全资子公司中美华东美国合作方ImmunoGen,Inc.宣布,其用于治疗铂耐药卵巢癌的全球首创(first-in-class)ADC药物mirvetuximab soravtansine-gynx获得美国FDA加速批准上市。
11.三迭纪宣布,其自主研发的第三款3D打印药物产品T21已获得美国FDA的新药临床试验申请(IND)批准。
12.荣昌生物宣布,美国FDA已同意公司产品泰它西普在美国开展治疗IgA肾病适应症的3期临床试验。
13.北海康成宣布其处于临床开发阶段的候选药物CAN106获得美国FDA授予的孤儿药资格,用于治疗重症肌无力。
14.歌礼制药发布公告称,美国FDA已批准其病毒聚合酶抑制剂ASC10针对猴痘适应症的新药临床试验申请。根据公告,本次获得批准的是一项随机、双盲、安慰剂对照的1b期研究,旨在评估ASC10片剂在猴痘病毒感染患者中的安全性、耐受性、疗效以及药代动力学。
医药企业观察
1,莱美药业及其控股子公司成都金星与成都金星少数股东德国沙奴姆公司、耀匀医药共同签署《成都金星健康药业有限公司增资和认购协议》,同意耀匀医药对成都金星进行增资,增资金额为人民币1.13亿元。本次增资完成后,耀匀医药将持有成都金星61.00%股权、莱美药业将持有成都金星35.10%股权、德国沙奴姆公司将持有成都金星3.90%股权,成都金星将不再纳入莱美药业合并报表范围。
2.先声药业与瑞士Idorsia公司就后者的新型抗失眠药物daridorexant在中国的开发签订独家许可协议。据悉,daridorexant是一款双重食欲素受体拮抗剂,已经获美国FDA批准上市。先声药业将获得在中国内地、中国香港和中国澳门地区开发和商业化daridorexant的独家权利。
3.神州细胞发布公告称,其控股子公司神州细胞工程有限公司拟以不超过5000万澳元的自有资金,投资设立神州细胞(澳大利亚)有限公司。
4.中国医药发布公告称,其全资子公司美康九州医药有限公司拟将其持有的上海新兴医药股份有限公司8364万股股份(持股比例 51%)以非公开协议方式转让给通用技术集团医药控股有限公司,转让对价为人民币9204.11万元。
5.华领医药发布公告称,其间接全资附属公司华领医药技术(上海)有限公司将收购南京盛德瑞尔医药科技有限公司100%股权,收购金额为102.5万元。此外,华领上海还与盛德瑞尔医药订立项目合作开发框架协议,在创新靶标和创新化合物领域开发孤儿药。
6.尔康制药发布公告称,拟使用自筹资金10亿元投资建设碳酸锂及其制剂项目,项目建设内容为碳酸锂及其制剂生产线工程,建设周期(含调试)预计为6个月。
药品集中采购
1.江西省医保局发布《十六省(市、区)联盟药品集中带量采购公告》。本次集采共包括13个品种,其中维生素D口服液体剂包括维生素D滴剂、维生素D2软胶囊,区分竞价组;而在骨肽注射剂类别中,包括骨肽注射剂、骨肽(I)注射剂,不区分竞价组。
2.上海阳光医药采购网发布《长三角(沪浙皖)联盟地区药品集中采购文件》,该联盟由上海、浙江、安徽组成,集采的对象是44个国家集采采购期即将届满的药品。本次药品集中采购周期自中选结果实际执行日起,以年为单位;各地首年约定采购量计算基数由各地确定;各品种首年约定采购量为各地首年约定采购量计算基数的60%。
3.北京市医保局发布《关于执行2021年京津冀药品联合带量采购及2022年北京市中成药带量采购中选结果有关工作的通知》,2021年京津冀药品联合带量采购中选药品及2022年北京市中成药带量采购中选药品,实行统一挂网、统一调价、带量采购。其他属于带量采购范围内价格适宜的非中选药品,可作为中选药品的补充进行采购销售。本次京津冀联采带量联动药品采购周期为1年,订单式采购短缺药品采购周期为2年;北京市中成药带量采购药品采购周期为2年。采购协议每年一签。采购周期内,如遇国家组织相同品种药品集中带量采购等情况,原则上按照国家政策要求有序衔接;同时动态联动全国各省级及省际联盟药品带量采购中选结果。【中国食品药品网综合整理/刘思慧】
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐