11月份中美欧批准上市新药盘点
- 2022-12-20 18:41
- 作者:陈倩
- 来源:中国食品药品网
11月份,中美欧共批准11款新药上市。其中,我国批准6款新药上市,美国和欧盟分别批准2款和3款新药上市,我国获批新药的数量超过了美国和欧盟。
我国批准6款新药上市
表1 2022年11月中国批准上市新药
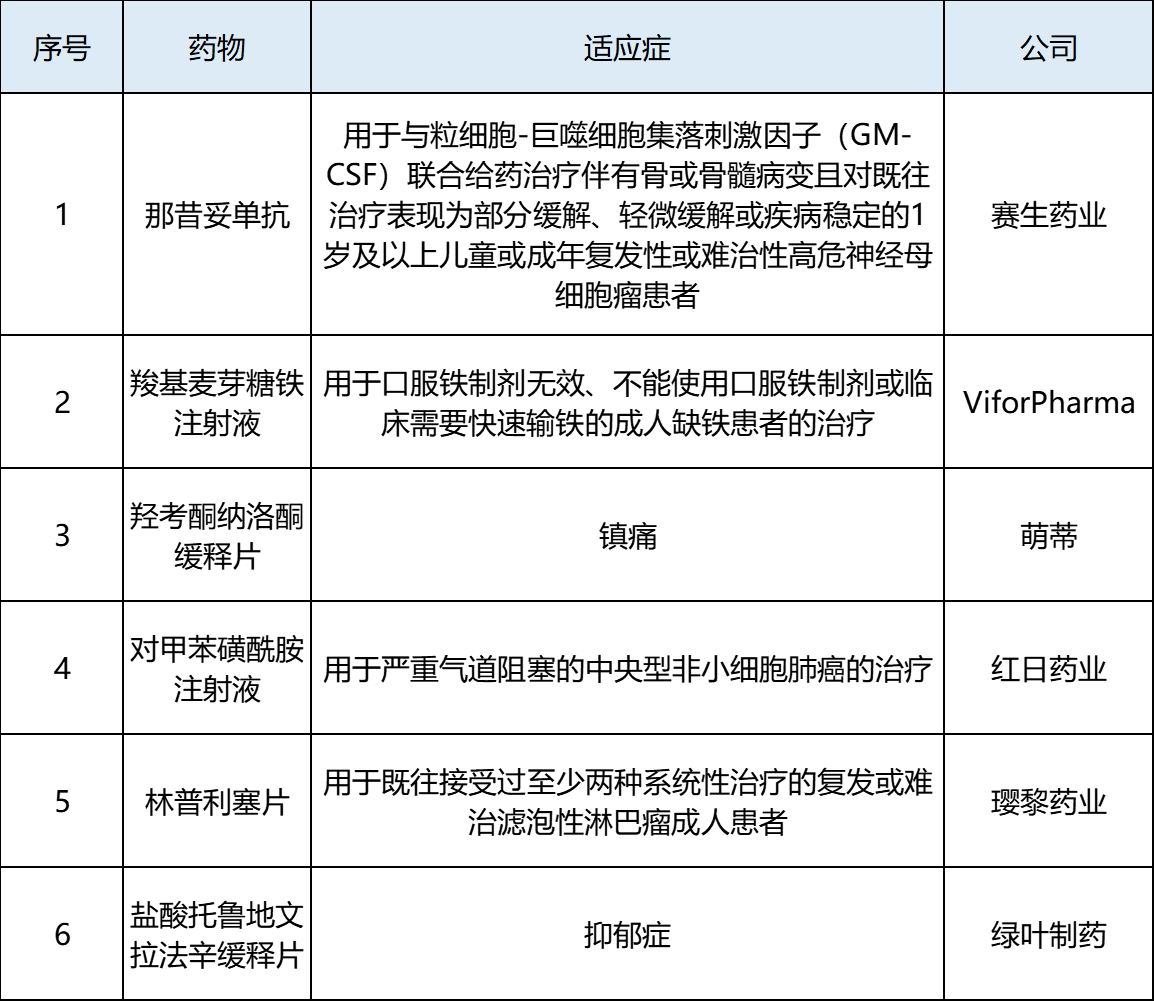
11月份,我国共批准6款新药上市,其中对甲苯磺酰胺注射液、林普利塞片和盐酸托鲁地文拉法辛缓释片为我国自主研发。
那昔妥单抗是美国Y-mabs公司研发的一款神经节苷脂GD2人源化单克隆抗体,通过靶向高表达于神经母细胞瘤的GD2起效。那昔妥单抗结合GD2后,可引起抗体介导的细胞毒性反应并激活补体系统,从而杀伤肿瘤。神经母细胞瘤是一种交感神经系统的恶性肿瘤,占儿童恶性肿瘤的8%~10%。其中,高危神经母细胞瘤患儿的预后较差,长期生存率不足50%。在获美国食品药品管理局(FDA)加速批准之前,该药曾获得FDA授予的优先审批资格、突破性疗法认定以及孤儿药认定。2020年12月,赛生药业以1.2亿美元引进了Y-mabs的包括那昔妥单抗在内的两款产品。
羧基麦芽糖铁注射液是瑞士维福制药(Vifor Pharma)研发的一种静脉注射铁疗法,可以短时间内给机体补充大量铁元素。此次批准是基于其Ⅲ期临床试验的结果。结果显示,在治疗第8周时,在任何时间点达到血红蛋白升高≥2g/dl患者比例达99.4%,有效改善患者的血红蛋白反应并纠正缺铁。羧基麦芽糖铁可以15分钟一次性输注1000mg铁,给药间隔时间也延长至1周,在有效改善铁缺乏和缺铁性贫血的同时降低治疗注射次数。
羟考酮纳洛酮缓释片是萌蒂药业研发的镇痛药,由强阿片μ受体激动剂盐酸羟考酮和阿片受体拮抗剂盐酸纳洛酮组成,用于治疗非阿片类药物不能有效控制的中重度慢性疼痛,并可有效防止阿片类药物,例如盐酸羟考酮引发的滥用问题,以及降低该类药物引起的便秘等胃肠道不良反应。
对甲苯磺酰胺注射液是红日药业研发的一款肿瘤体内注射的高效、广谱、低毒、特异识别染色的抗肿瘤创新药物,其进入肿瘤细胞后通过促进溶酶体破裂、提高胞浆内过氧化氢活性及抑制线粒体ATP合成酶的活性,促进肿瘤细胞凝固性坏死,对正常细胞的损伤相对较少,是我国首次批准的经纤维支气管镜肿瘤内局部注射的化学消融药物。
林普利塞片是璎黎药业研发的磷脂酰肌醇3-激酶的δ亚型(PI3Kδ)选择性抑制剂,PI3Kδ是PI3K蛋白家族中的一员,主要存在于白细胞中,PI3Kδ信号在多种B细胞淋巴瘤中处于活化状态。PI3Kδ在调节适应性免疫系统细胞(B细胞和部分T细胞)以及先天免疫系统(中性粒细胞、肥大细胞和巨噬细胞)中具有重要作用,因此,其被认为是治疗血液系统恶性肿瘤的理想靶点之一。一项Ⅱ期临床试验结果显示,在89例可评估的复发/难治滤泡性淋巴瘤患者中,林普利塞片的客观缓解率(ORR)达80%以上,疾病控制率(DCR)达95%以上。
盐酸托鲁地文拉法辛缓释片是绿叶制药研发的治疗抑郁症新药,其抗抑郁作用可能与通过抑制5-羟色胺(5-HT)、去甲肾上腺素(NE)的再摄取而增强中枢神经系统的5-HT、NE效应有关。传统抗抑郁药物,如选择性5—羟色胺再摄取抑制剂(SSRIs)、5—羟色胺—去甲肾上腺素再摄取抑制剂(SNRIs)存在快感缺乏、性功能障碍、无法改善认知障碍等药物缺陷。盐酸托鲁地文拉法辛缓释片本次获批基于其Ⅲ期中国成人抑郁症患者临床试验,结果显示,患者服用盐酸托鲁地文拉法辛缓释片在各个精神评估量表对比安慰剂组均显示出统计学优势。
美国批准2款新药上市
表2 2022年11月美国批准上市新药

11月份,美国批准2款新药上市,分别为Teplizumab(商品名:Elahere)和Mirvetuximab soravtansine(商品名:Elahere),均为全球首次批准。
Teplizumab是由MacroGenics研发,而后于2018年被Provention买入的人源化抗CD3单克隆抗体,是全球首款可以延缓1型糖尿病发作的药物。其通过与效应T细胞表面的CD3结合,抑制T细胞对胰岛β细胞的攻击,从而保护胰岛β细胞不受破坏。此次获批是基于一项Ⅲ期临床试验结果,试验共纳入76名1型糖尿病患者,结果显示,接受Teplizumab治疗的44名患者中有45%最后被诊断出患有3期1型糖尿病,而安慰剂组的比例为72%;Teplizumab治疗组患者出现疾病进展的时间约为50个月,而安慰剂组则为25个月。
Mirvetuximab soravtansine是由ImmunoGen研发的靶向叶酸受体α(FRα)的抗体偶联药物(ADC),通过可裂解的连接子将FRα抗体和美登素生物碱DM4载荷(一种强效的微管蛋白靶向剂)。本次获批是基于其名为SORAYA的试验,试验纳入FRα高表达、先前已接受过1-3线治疗方案的铂耐药卵巢癌患者,结果显示,约1/3的患者达到研究者评估的ORR。2020年10月20日,华东医药宣布与ImmunoGen达成合作协议,引进Mirvetuximab Soravtansine大中华区权益。
欧盟批准3款新药上市
表3 2022年11月欧盟批准上市新药
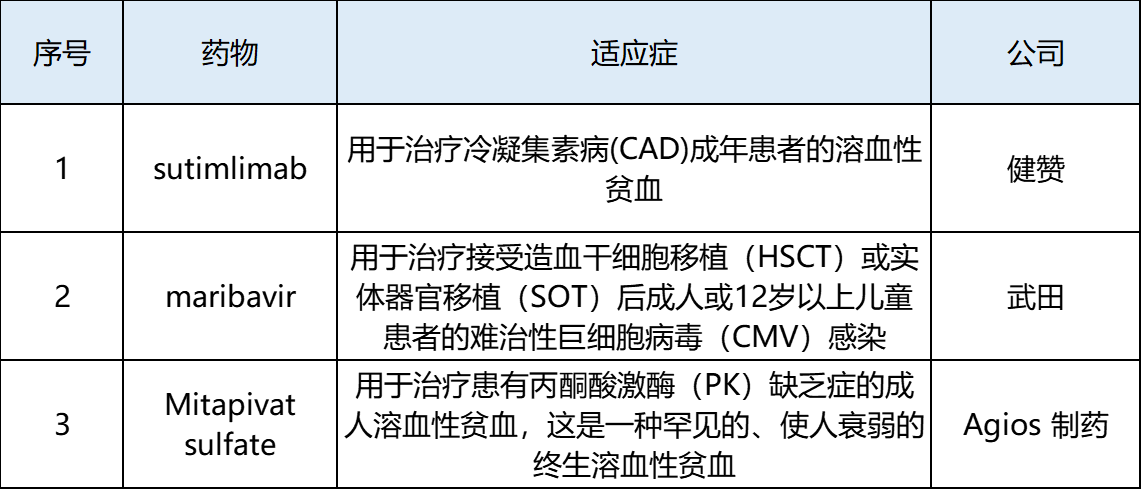
2022年11月,欧盟批准了3款新药上市,分别为Sutimlimab(商品名:Enjaymo)、 Maribavir(商品名:Livtencity)和Mitapivat(商品名:Pyrukynd)。
Sutimlimab是美国健赞公司研发的第一个也是唯一一个获准用于冷凝集素病患者的治疗方法,Sutimlimab通过抑制免疫系统补体级联反应的激活,阻断补体C1复合物的组分(C1s),从而抑制冷凝集素病(CAD)中因补体C1激活的溶血。CAD是一种罕见的自身免疫性溶血性贫血,身体的免疫系统会错误地攻击健康的红细胞并导致其破裂,即溶血。在美国、欧洲和日本,CAD影响了大约12000人的生活。此次欧盟的批准是基于2项Ⅲ期临床试验的数据:CADENZA,一项在近期无输血史(过去6个月内)的CAD成人患者中开展的双盲、安慰剂对照试验;CARDINAL,一项为期26周的,在近期接受过输血的CAD患者中进行的单臂试验。结果显示,Sutimlimab组均达到主要终点,表现对溶血的抑制和血红蛋白水平的改善。
Maribavir由武田公司研发是第一个也是唯一一个抑制巨细胞病毒(CMV)特异性UL97蛋白激酶及其天然底物的口服治疗药物。与已有疗法相比,Maribavir作为一线疗法预防CMV复发时,具有更高的安全性。在治疗耐药或难治性CMV感染时,Maribavir达到66.7%的缓解率。CMV是移植患者最常见的感染之一,在接受实体器官移植的患者中全球发病率约为16%~56%,在接受造血干细胞移植患者中的全球发病率约为30%~80%。
Mitapivat是Agios制药研发的一种口服丙酮酸激酶(PK)激活剂创新药,也是首个获批的患有PK缺乏症的成人溶血性贫血的改善病情疗法。此次上市是基于2项关键性研究ACTIVATE和ACTIVATE-T的结果。在ACTIVATE试验中,不定期输血的丙酮酸激酶缺乏症患者中,Mitapivat组相对于安慰剂组的血红蛋白缓解具有统计学意义;在ACTIVATE-T试验中,Mitapivat能显著减少需要定期输血的患者的输血负担。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐