每周医药看点(12.21—12.27)
- 2023-01-30 09:28
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 新型冠状病毒感染实施“乙类乙管”总体方案公布;国家药监局、海关总署联合发布《关于麻醉药品和精神药品进出口管理有关事宜的公告》……12月21日—12月27日,医药行业的这些动态值得关注。
行业政策动态
1.国务院应对新型冠状病毒感染疫情联防联控机制综合组发布《关于印发对新型冠状病毒感染实施“乙类乙管”总体方案的通知》。《通知》指出,自2023年1月8日起,对新型冠状病毒感染实施“乙类乙管”。依据传染病防治法,对新冠病毒感染者不再实行隔离措施,不再判定密切接触者;不再划定高低风险区;对新冠病毒感染者实施分级分类收治并适时调整医疗保障政策;检测策略调整为“愿检尽检”;调整疫情信息发布频次和内容。依据国境卫生检疫法,不再对入境人员和货物等采取检疫传染病管理措施。
2.国家药监局、海关总署联合发布《关于麻醉药品和精神药品进出口管理有关事宜的公告》,进一步深化“放管服”改革,加强麻醉药品和精神药品进出口管理,促进麻醉药品和精神药品跨境贸易便利化和规范化。《公告》明确,国家对麻醉药品和精神药品实行进出口准许证管理。进口、出口麻醉药品和精神药品应当取得国家药监局颁发的进口准许证、出口准许证。进口麻醉药品和精神药品无需办理进口药品通关单。
3.国家药监局综合司就《中药品种保护条例(修订草案征求意见稿)》公开征求意见,征求意见截止日期为2023年1月24日。征求意见稿调整了中药品种保护的等级和期限,在市场独占保护的基础上增设中药品种保护专用标识的保护形式,取消延长保护期制度,促进中药品种创新以及持续提高。征求意见稿将中药品种保护分为三级:一级保护给予十年市场独占,二级保护给予五年市场独占,一级、二级保护同时给予中药品种保护专用标识,三级保护仅给予五年中药品种保护专用标识。中药品种保护期届满后,不得再以相同的事实和理由获得保护;做出新的显著改进或者提高、符合规定情形的,可以再次获得中药品种保护。
4.国家药监局药品审评中心(CDE)发布《同名同方药研究技术指导原则(试行)》。《指导原则》明确,同名同方药的研发应当科学合理选择同名同方已上市中药作为对照药,对照药应当具有临床价值。原则上同名同方药的功能主治应当与对照药相同。申请人应当充分评估对照药的临床价值。应当选择临床价值依据充分的已上市中药,进行同名同方药研发。对于临床价值不确定、存疑或依据不充分的情形,申请人应当慎重考虑是否进行同名同方药的研发,如开展同名同方药研发,应当进行临床试验。对于同名同方已上市中药存在多家生产、多个文号的情况,《指导原则》要求,同名同方药的研发应当选择经评估临床价值依据充分的品种作为对照药。同名同方药的药材基原、药用部位、饮片炮制等内容应当与所选的对照药一致。
5.CDE发布《中药新药用于慢性胃炎的临床疗效评价技术指导原则(试行)》《中药新药用于胃食管反流病的临床疗效评价技术指导原则(试行)》,旨在推动构建中医药理论、人用经验和临床试验相结合的中药注册审评证据体系,探索符合中医药特点的疗效评价标准。
6.CDE就《罕见疾病药物开发中疾病自然史研究指导原则(征求意见稿)》公开征求意见,征求意见截止日期为2023年1月20日。《征求意见稿》首先介绍了疾病自然史研究定义,强调疾病自然史研究预先的计划性,与目前临床中已在采用的疾病注册登记系统并不完全等同;其次介绍了疾病自然史研究的应用场景、疾病自然史研究模式;最后介绍了疾病自然史研究的实施。
7.CDE就《预防用疫苗免疫原性桥接临床试验技术指导原则(征求意见稿)》公开征求意见,征求意见截止日期为2023年1月20日;就《非阿片类术后镇痛新药临床试验设计技术指导原则(公开征求意见稿)》公开征求意见,征求意见截止日期为2023年1月21日。
8..CDE网站公示7个仿制药一致性评价任务,涉及乳酸环丙沙星氯化钠注射液等药品。(截至12月27日)

产品研发上市信息
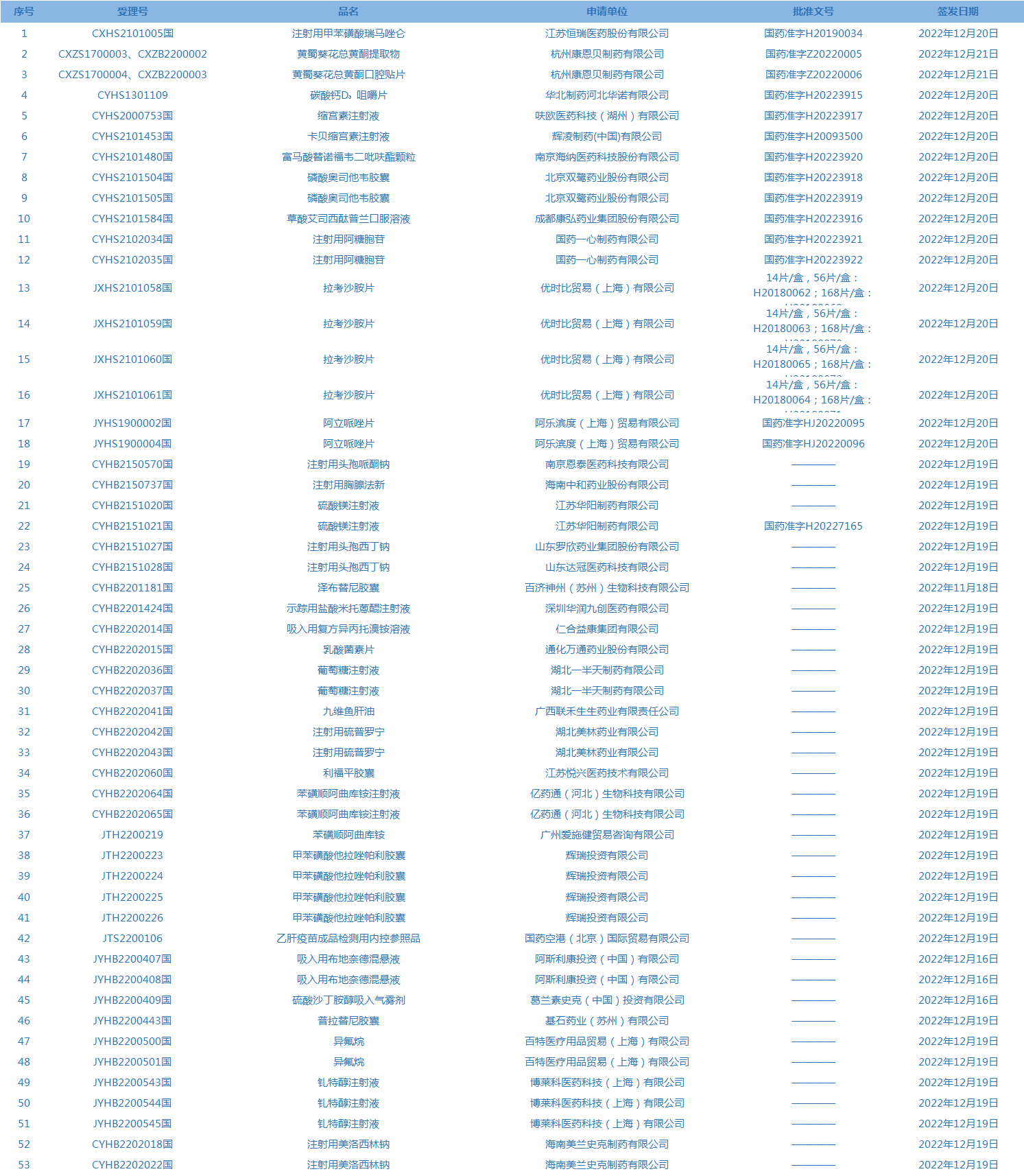
1.国家药监局发布3期药品批准证明文件送达信息,共包括53个受理号,涉及江苏恒瑞医药股份有限公司等企业。(截至12月27日)
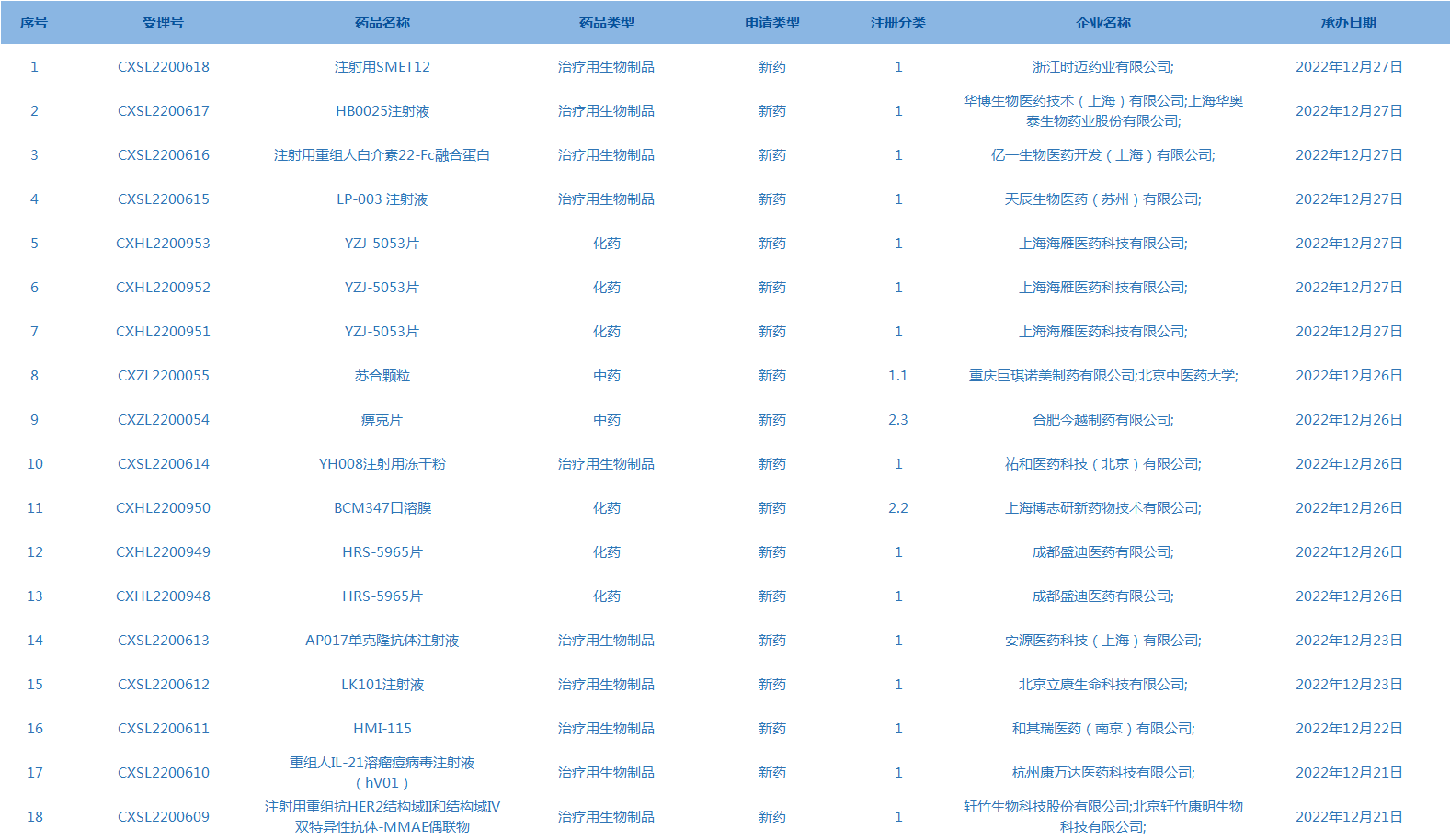
2.CDE承办受理18个新药上市申请,包括注射用SMET12等药品。(截至12月27日)
3.舶望制药宣布,其自主研发的首款siRNA新药Ⅰ期临床试验申请已获得澳大利亚药品监督管理局的批准。
4.石药集团宣布,其附属公司NovaRock Biotherapeutics研发的全人源抗体药物NBL-020的新药临床试验申请已获美国食品药品管理局(FDA)批准,可在美国开展用于治疗晚期实体瘤的临床试验。
5.德睿智药宣布,其研发的口服小分子药物、GLP-1受体激动剂MDR-001已获得美国FDA临床批件,针对适应症为肥胖。该公司预计于2023年一季度启动Ⅰ期临床研究。
6.华夏英泰宣布,其自主开发的合成性T细胞受体抗原受体(STAR-T)注射液(研发代号:YTS104)获得美国FDA授予孤儿药资格,用于治疗复发/难治急性髓系白血病(R/R AML)。
7.普利制药发布公告称,其收到了美国FDA签发的林可霉素注射液批准通知。
8.人福医药发布公告称,其控股子公司武汉普克收到美国FDA关于盐酸金刚烷胺软胶囊的批准文号。
9.汇宇制药发布公告称,其全资子公司Seacross Pharma(Europe) Limited收到德国联邦药品和医疗器械机构核准签发的紫杉醇注射液的上市许可。
医药企业观察
1.科伦药业发布公告,其控股子公司科伦博泰与默沙东签署《独占许可及合作协议》,科伦博泰将其管线中7种不同在研临床前抗体偶联药物(ADC)项目以全球独占许可或独占许可选择权形式,授予默沙东在全球范围内或在中国内地、香港和澳门以外地区进行研究、开发、生产制造与商业化的权利。
2.君实生物宣布与英国Hikma Pharmaceuticals达成许可与商业化合作,将在沙特阿拉伯、阿联酋、卡塔尔、约旦、摩洛哥、埃及等中东和北非地区的共20个国家对抗PD-1抗体特瑞普利单抗进行开发和商业化。
3.德琪医药宣布与默沙东达成一项全球临床合作,双方将共同开展一项多中心、开放性、1期剂量探索研究(STAMINA-001试验),以评估德琪医药的CD73小分子抑制剂ATG-037单药及联合默沙东的PD-1抑制剂帕博利珠单抗(Keytruda)用于治疗局部晚期或转移性实体瘤患者的安全性和初步疗效。
4.迈威生物宣布与俄罗斯制药公司Binnopharm Group就三款生物类似药在俄罗斯和欧亚经济联盟地区内的开发、生产和销售达成战略合作协议,分别为阿达木单抗生物类似药9MW0113、地舒单抗生物类似药9MW0321(预防肿瘤骨转移)和9MW0311(治疗骨质疏松)。
5.国药一致发布公告,其下属全资子公司国控广州与广州南沙经济技术开发区投资促进局签订项目投资协议,拟投资约9.8亿元建设国药生命健康南沙产业园。
6.丹诺医药宣布完成D+轮融资。参与D+轮融资的投资机构包括北创投和博润投资,D轮的领投机构之一燕创资本在D+轮继续加持。本次融资是该公司对今年上半年完成的D轮融资的扩展,D和D+轮融资的交易总额为3.3亿元人民币,获得资金将用于推进其核心产品的后期临床试验。
7.丹码生物宣布完成近2000万美元的A1轮融资。本轮融资由龙磐投资领投,德联资本跟投。融资资金将主要用于产品管线的推进和技术平台建设。
药品集中采购
1.河南省医保局发布《十六省(区、兵团)药品集中带量采购文件》,本次接续采购统筹考虑国采时竞争是否充分、降价是否到位等因素,区分采购单一、采购单二分别进行集中带量采购(具体分组另行公布)。由医药机构结合上年度实际使用量、临床使用状况和医疗技术进步等因素报送拟采购药品的需求量,以不低于医药机构上报需求量的80%作为约定采购量(抗菌类药品以医药机构上报需求量的80%作为约定采购量)。医疗机构中选产品使用量不低于同品种药品用量的80%。
2.江西省医保局发布《关于十六省(市、区)联盟药品集中带量采购拟中选结果公示的通知》,13个品种拟中选,包括盐酸罂粟碱注射液、注射用盐酸托烷司琼、天麻素注射液等。
3.浙江省公立医疗机构第三批药品集中带量采购拟中选结果揭晓。本次集中带量采购共涉及22个品种,经评审产生拟中选结果,总体平均降价48%,根据约定采购量计算,预计可减少采购支出超2.8亿元。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐













