全面关注公众用药需求 “同情用药”制度建立提上日程
- 2018-01-02 17:58
- 作者: 落楠
- 来源:中国健康传媒集团-中国医药报
“我们这个群体对‘同情用药’关注已久,也有病友曾尝试到海外获取‘同情用药’”,罕见病发展中心创始人黄如方介绍,对很多患者来说,一些药物有可能终止严重症状进展或是挽救生命,早一天用上就早一天有可能获得生命的希望。2017年8月,该中心曾组织了一个包括病友和医护人员、企业代表的小型研讨会,介绍了“同情用药”制度。“当时我们认为在中国实现‘同情用药’还不太容易,没想在4个月后就看到了希望。”
中国医药报记者 落楠 报道 2017年12月20日, 国家食品药品监管总局发布《拓展性同情使用临床试验用药物管理办法》(征求意见稿)(以下简称《征求意见稿》),拟允许在一些特定情况下,给急需的患者在开展临床试验的机构内使用尚未得到批准上市的药物。这被业内人士视作建立中国版“同情用药”制度的信号。
多点出击控风险
对“同情用药”也不乏担心的声音:未经批准上市的药物直接给到患者,要“冷思考”,要“且行且珍重”。事实上,“同情用药”制度在国际上践行多年,已经积累了相当丰富的经验。在方恩(天津)医药发展有限公司董事长张丹看来,“《征求意见稿》充分借鉴了国际经验,从多个方面来防范风险”。
在《征求意见稿》中,企业、临床试验机构、监管方都必须承担相应责任,从而最大限度降低风险:
对企业来说,除了提交该药物安全有效的证据外,还需要制定严格的操作规程,参考药物临床试验质量管理规范(GCP),监督拓展性临床试验的进行。
对研究者来说,除了掌握患者病情及进展情况外,还要为患者使用药物的“获益大于风险”背书。同时,研究者也是知情同意告知和不良反应事件收集两项关键任务的负责人。
对药审中心来说,除了评估企业提供的相关资料外,还需要平衡新药上市时间对患者需求满足程度的影响,如果拓展性临床试验影响到注册临床试验的顺利开展,则药审中心有权要求停止拓展性临床试验。
“《征求意见稿》的目的是鼓励突破性创新,让成果早日惠及患者。但为了防止‘滥用’,《征求意见稿》结合中国国情,提出一些限制性措施,以保障各方权益。比如说,不同于某些国家的做法,我国拓展性临床试验的申请人仅有注册申请人,而大多数注册申请人是企业。”中国医药科技成果转化中心主任芮国忠认为,这一方面是考虑到我国患者对新药信息的获悉不一定及时、准确;另一方面也是因为如果发生风险,企业的应对能力大于患者个体。
值得一提的是,《征求意见稿》分别说明了注册申请人、研究者和药审中心在不良反应事件中的角色,从而构建起保护患者的完整闭环,“这点甚至ICH(国际人用药品注册技术协调会)成员国日本都尚未做到。”一位业内人士告诉记者。
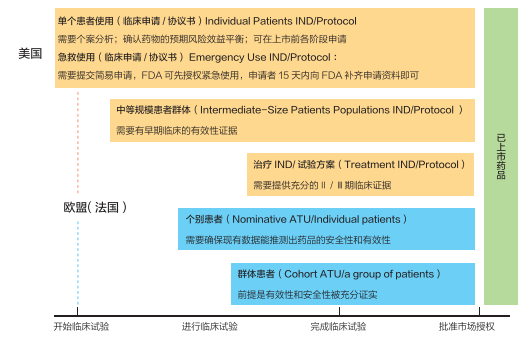
表 美国与欧盟(法国)“同情用药”的适用范围及适用申请阶段
(信息来自《Regenerative Therapy》,本报实习记者李雅楠整理)
权衡利益与隐患
对企业来说,是否开展“同情用药”,需要充分权衡利益与隐患。
芮国忠认为,拓展性临床试验事实上有助于企业降低研发成本。“开展拓展性临床试验的企业可以从患者身上获得有用的数据,这对药品的开发和适应证选择是有帮助的,尤其在国内外临床试验费用上升的大环境下,获取更多的药物对人体的实用性数据,其实是有助于降低成本的。”
“企业能从拓展性临床试验中间接获益。” 张丹说,拓展性临床试验对企业的吸引力在于:一方面,源于“同情用药”患者的数据能为企业补充安全性数据库所需要的数据——这是药品获批的三个关键数据之一。另一方面,如果按照GCP的要求认真执行,收集到的数据能给企业后续研发提供思路,使企业避开可能的失误,优化后续临床试验。此外,在拓展性临床试验中,伦理委员会、医院和医护人员都对试验产品有了了解,这有利于进一步促成企业与医院在药品临床试验环节和上市后使用阶段的合作。
张丹提醒企业,开展拓展性临床试验需要企业投入大量的金钱和精力。企业要进行临床试验伦理申报、设计给药方案,还要建立一整套系统来监测并上报患者的相关数据及不良事件。
此外,能否掌控医疗机构开展“同情用药”的具体情况,也给企业带来相当的考验。“在Ⅰ期~Ⅲ期临床试验中,企业对药品的研究是循序渐进的,能依据前一个环节的数据及时调整后续环节的试验用药的用量。但拓展性临床试验是一个跨越式的环节,在研药品被直接用作治疗用药,企业对于药品的用量、用法存在顾虑,也担心如果临床试验机构使用药物不当,会对研发带来反作用。”芮国忠补充道。
在国外,不乏因“同情用药”的意外事件导致产品正常研发推迟的案例。以美国加州药企CytRx为例,因一名患者纳入“同情用药”项目后死亡,美国食品药品管理局(FDA)对相关产品的一项临床研究发出了“部分暂停”的命令。尽管该公司澄清,“这名患者在入组前就患有晚期癌症,并不符合公司任何一项临床研究的入组标准”,但仍需重新修改该产品的所有临床方案,包括制定新的入组/排除标准和患者筛查评估程序,给药前进行血清检测等。两个月后,FDA才解除了上述限制。
芮国忠提醒,如果企业确定要开展拓展性临床试验,企业和临床试验机构必须就责任界定提前进行协商并形成协议,以免最糟糕的情况发生后,双方推诿责任。“我的建议是,如果问题出在药品质量上,则企业负责;如果是由于使用不当发生伤害,临床试验机构要担责。”
准确划分责任的前提是要保证试验数据真实,因此有必要对拓展性临床试验进行全链条的稽查,严防数据造假。“在监管部门严查临床数据造假、临床试验机构资格认定改为备案管理后,企业应该选择与那些愿意接受企业监督的临床试验机构合作。”张丹说。
培训教育正当时
在张丹看来,相关机构要从现在就开始为患者、企业和临床试验机构介绍国外“同情用药”的案例,让他们做好开展拓展性临床试验的准备。
开展拓展性临床试验最为关键的是,患者的权益必须得到充分保护。一方面,接受“同情用药”的患者不是一般的受试者,而是正面临严重生命威胁的患者,其中部分患者更是因生理原因无法进入临床试验组的特殊群体;另一方面,用作治疗的药物还是临床试验产品,治疗的结果具有不确定性。在这种情况下,企业和临床试验机构必须在伦理上有更充分的考量。北京大学医学人文研究院教授丛亚丽认为,必须强化对患者的告知程序,不要让签署知情同意书变成一种形式。在此之前,还要为患者建立多重保护措施。比如,为患者开展“同情用药”的临床医生或研究者必须对相关药品有着充分了解;同时,为了防止判断失误,还必须有一个机构来对患者用药的合理性进行审核,以保护患者。“伦理委员会是一个可选机构,或可考虑效仿国外的做法,成立专门的‘同情用药’咨询委员会。”丛亚丽说。
“患者自身也要对‘同情用药’有充分的认识。”黄如方认为,患者教育必须跟上。患者及其家属需要更加客观地看待“同情用药”,勇于承担可能的风险。“在企业和临床试验机构对患者设置完善的保护措施的基础上,如果最糟糕的情况发生,不能把所有的责任都推到企业和临床试验机构身上。”在他看来,如果苛求企业和临床试验机构承担不适当的责任,可能会打击企业和临床试验机构开展拓展性临床试验的积极性,使患者群体获得救助的机会减少。
相关链接
“同情用药”伦理学原则 以埃博拉试验用药物/疫苗应用伦理学原则为例
1.协作关系
当地社会和利益相关者参与计划、实施和监督临床试验;确保利益相关方在临床试验实施或结果中获益(例如,加强卫生系统建设,帮助获得批准的治疗或疫苗)。
2.社会价值
确保数据真实可靠(例如,告知大众需要进一步试验、上市或退市的决定);传播知识。
3.科学价值
根据相关数据制订计划(例如,临床前数据、同情性使用数据);确保临床试验能够实现科学目的(例如,随机分配受试者获得试验性药物+支持治疗,或安慰剂对照+支持治疗);确保试验的可操作性(例如,拥有足够的基础设施来监测受试者并收集数据)。
4.公平选择研究对象
选择标准应保持透明,并始终坚持该标准;选择能确保研究结果科学真实的对象(例如,排除病情严重的埃博拉患者,以减少副作用的混杂因素);避免富有者、有优越社会关系的人优先。
5.有利的风险-获益比
根据所有相关数据评估受试者的风险和可能的获益;使受试者的风险最小化(例如,提供支持治疗,监测副作用,建立数据和安全监测委员会)。
6.独立审查
通过伦理审查或监督确保公众问责;通过保证透明性(例如,第三方或非政府组织审查),确保公众问责。
7.知情同意
披露信息,并以合适的方式和语言形式获得自愿和知情同意;合适的情况下实施社区和家庭额外的知情同意;确保拒绝和退出的自由。
8.尊重受试者和研究团体
监测和治疗医源性失调(例如,副作用、试验中研究相关的损伤);保护受试者隐私;在研究过程中向受试者提供相关信息; 为研究造成的损伤提供补偿;向受试者及研究团体告知研究结果。(信息来自《柳叶刀》杂志,本报记者落楠整理)
延伸阅读
“救救Josh”
对于9个月大就被确诊患有肾脏恶性横纹肌样肿瘤、7岁时因骨髓移植受到腺病毒感染的美国弗吉尼亚州男孩Josh Hardy来说,“同情用药”给了他一个能够健康活着的机会。但这次“同情用药”,也给生产抗病毒药物的美国Chimerix公司和最终做出给药决定的该公司CEO带来了巨大压力。
在感染腺病毒之前,Josh在家人的支持下已经熬过了一轮又一轮的化疗、放疗和手术,成功战胜了原位肿瘤和两轮转移。还没来得及庆祝骨髓移植的胜利,Josh的家人就被医生告知:小Josh的肾功能不允许他接受常规的腺病毒治疗;如果病毒感染得不到控制,一切努力都将功亏一篑,Josh的生命也将很快走到尽头。医生说,Chimerix公司已经完成Ⅲ期临床研究的产品Brincidofovir或许对Josh有用。Josh的父亲很快与Chimerix公司取得了联系,但得到的回复是,拒绝。再问,再拒。
Chimerix公司并非不近人情:在Brincidofovir刚刚被证实安全有效时,该药曾以“同情用药”的方式治疗过数位患者。作为一家小型创新药研发公司,没有已上市产品作为收入来源,成立14年来累计亏损1.73亿美元,Chimerix需要尽快让该产品上市。2012年,该公司决心集中资源加速Brincidofovir的上市进程,于是向美国食品药品管理局(FDA)申请终止了“同情用药”计划。这一次,他们不愿为Josh破例。
Josh的父母没有放弃。在一个非营利组织的帮助下,“救救Josh”这个话题通过各类媒介迅速传播,并最终获得了全美主流媒体的关注。Facebook也为Josh专门建立主页,呼吁网友点赞支持Josh。一周内,该页面获得了逾2.7万个“赞”。更有狂热者用电话、邮件、推特等方式向Chimerix公司施压,希望其为Josh提供帮助。
终于,Chimerix公司以新增临床试验的方式帮助Josh获得了药物。不久,Josh的病情明显好转并出院。但是,Chimerix公司做出“同情给药”决定的CEO没有等到Josh出院就被迫辞职了。批评者认为,CEO的决策虽然为Josh新增了临床试验机会,但也会推迟其他患者获得药物的时间。
故事有个悲伤的结局:尽管Josh如愿获得了药物并治愈了感染,但这并没有挽救他的生命。2017年9月,Josh辞世。然而不管怎样,“同情用药”曾带给Josh生活质量的改善和生命的希望。(本报实习生李雅楠编译整理)
(责任编辑:郭思男)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐
-
第26期“安安有约——食药科普大讲堂” 美丽520:破解化妆品谣言正当时
5月20日,坊间颇具浪漫色彩的一天,广东省药品监督管理局主办的第26期“安安有约——食药科普大讲堂活动”在广州举行,化妆品专家蒋丽刚《破解化妆品谣言》的专题讲座也如期开讲。 2019-05-27 09:55 -
42a0b751-7d56-4b1c-a143-a99f7da2fa3c_260x150c.jpg)
科普大讲堂
2019-04-28 15:07
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有









