同情用药制度:罕见病患者的又一道曙光
- 2020-02-29 12:40
- 作者:袁妮 李定国
- 来源:中国食品药品网
2020年1月31日,《新英格兰医学杂志》(NEJM)报道了一篇关于美国首例确诊新冠肺炎患者,在同情用药的原则下,使用吉利德公司尚未获批准的试验性药物"Remdesivir"(瑞德西韦)后,病情出现好转的文章。这使得同情用药制度在中国备受瞩目,同时也掀起了一场对同情用药制度追本溯源及如何移植到国内的探讨和研究。
梳理国外的同情用药制度,有几点是需要说明的:第一,同情用药制度并不是某一个国家或者少数几个国家特有的,但它多存在于发达国家;第二,不同国家对同情用药制度有不同的名称,虽然叫法不同,但制定该制度的初心一致,即解决一类特殊的弱势患者人群的药物可及问题;第三,同情用药制度的核心问题体现在药品安全性及医学伦理学问题,即安不安全、该不该用。
在了解同情用药国际经验的基础上,进一步明确该制度的几个问题及其在罕见病患者药物可及性的实际应用非常重要。
同情用药制度需要明确的几个问题
同情用药的概念
在欧美一些国家,有一类制度或者计划,与同情用药制度类似,统称为早期准入计划(Early access programs,EAPs),是指在符合特定标准,按照特定条款的前提下,向特定患者提供未取得上市许可药品的一项特殊国家监管制度。其中包括美国的同情用药(Compassionate Use, CU)和扩展使用(Expanded Access, EA)、欧盟的患者用药计划(Named Patient Programme, NPP)、英国的早期获取药物计划(Early Access to Medicines Scheme, EAMS)、法国的临时使用授权(Autorisation Temporaire d’utilisation, ATU)等。在我国之所以使用同情用药这个词,主要是由于在这次新冠肺炎疫情中,美国对瑞德西韦药物的报道使用了同情用药的概念,使得它深入人心。而原国家食品药品监管总局于2017年12月发布的《拓展性同情使用临床试验用药物管理办法(征求意见稿)》(以下简称《征求意见稿》)中使用的拓展性同情使用的概念也是源自美国FDA的官方提法。
这些制度虽然提法不同,但究其本质都具有以下共同特征:第一,针对未上市药品;第二,临床急需;第三,用于临床试验以外的患者。上述特征也同样满足于罕见病患者的用药条件(罕见病是指发病率很低、很少见的疾病,一般为慢性、严重的疾病,常常危及生命)。
同情用药的费用问题
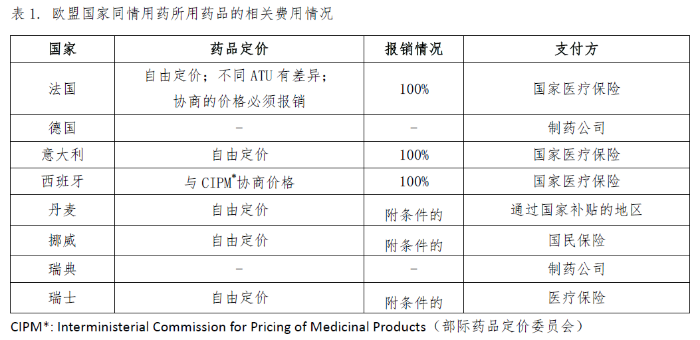
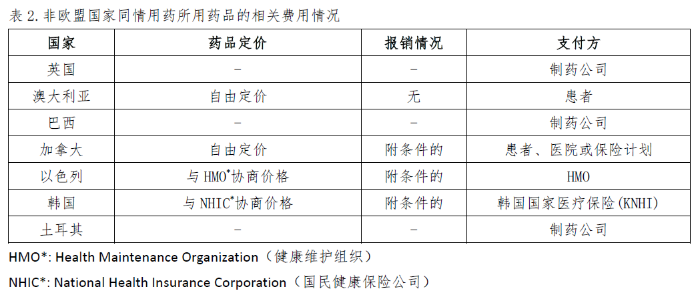
不同的国家和地区关于同情用药的药品定价、报销比例以及费用支付方的规定不尽相同,详见表1和表2。
药品尝试权
2018年,美国修订《联邦食品、药品和化妆品法》明确提出"药品尝试权(Right to Try)",是被诊断患有威胁生命的疾病且尝试过所有批准的治疗方案并无法参加临床试验的患者,获取某些未经批准的治疗方法的另一种方式。当患者申请同情用药,被美国FDA和审查委员会(Institutional Review Board,IRB)拒绝后,利用尝试权患者可绕过上述机构的审查使用试验性药物。
通常,适用于药品尝试权的试验性药物应满足四个条件:①已完成Ⅰ期临床的试验药物;②尚未经美国FDA批准或许可用于任何用途的药物;③正在美国FDA批准的临床试验中接受审查的药物;④制造商正在积极进行开发或生产,且尚未被美国FDA强行退出的药物。
同情用药与off-label的比较
off-label是指超说明书用药,亦称"药品未注册用法"或"药品说明书外用法",是指药品使用的适应证、剂量、疗程、途径或人群等未在药品监管部门批准的药品说明书记载范围内的用法。本文进行比较的off-label是在专家达成共识的情况下,对于off-label其他情况不做探讨。在此前提下,两者相比既有相似之处,亦有不同。
相同点主要有:
①两种情况都是针对未经批准的药物使用问题,皆用于特殊患者人群,按照特殊的程序,需要满足特殊的标准。
②两种情况都是非正常状态下使用药物。
③两种情况都需要患者签署知情同意书。
不同点主要有:
①两种情况应用主体不同。同情用药主要是针对未上市药物的适应证;off-label则针对已上市药品但没有获批的适应证。这里需要解释的是,同情用药制度下的适应证即包括提出临床试验申请的适应证也包括未提出申请的适应证。
②两种情况的合规性不同,即使用的法律规范不同。同情用药制度目前在我国仅有新修订《药品管理法》第二十三条的规定,《征求意见稿》没有最后实施,所以这一法条没有具体的实施细则。而off-label在有专家共识的情况下,经患者签署知情同意书后,一般是可以直接使用药品的。
③两种情况药品的安全性程度不同。同情用药使用的药品是没有经过审批的,其安全性有待确认;而off-label使用的是已上市临床使用一段时间的药品,用于“超适应症”治疗。与安全性相比其有效性更需要进一步验证。
④两种情况的时效性不同。在同情用药制度下的药品使用是临时性,一般时间较短,待药品上市后,就转化为正常用药。而off-label的药品在某些情况下会长期使用。
⑤两种情况的病人数量不同。同情用药分为个体病人和一组病人(美国分为中等规模和大规模),off-label用于多个病人。
⑥两种情况的发起人不同,同情用药多是医生或者企业发起,off-label则不确定。
⑦两种情况的定价情况不同。同情用药大多是由企业自由定价,off-label的药品有确定的上市价格。
同情用药制度在罕见病领域应用的对策建议
同情用药制度可以满足罕见病患者尽早使用处于临床阶段的试验性药物,包括申请在国外尚未上市的试验性药物的需求。目前,建议相关部门在新修订《药品管理法》第二十三条基础上,尽快完善"拓展性同情使用临床试验用药物管理办法"或类似的实施细则,对同情用药类型、审批流程、责任主体、费用分担及医学伦理学等进行明确,确保用药者安全与健康权益。
"简单灵活的方式,快速获批的程序,合理有效的费用分担机制,保障药品安全性的措施,确保患者的用药知情权,公开透明的信息平台,适当的激励政策"是实施罕见病药物同情用药制度需考虑的重要方面。
具体而言,在罕见病药物可及层面,第一在流程设置上应明确不同申请类别的审批程序及责任主体,采取分类管理的方法,设计合理的审批时限,最大程度简化程序加快患者用药速度。第二,建立专门的职能部门负责同情用药相关申请,组建高度专业化审核团队,高效地进行材料审查;在审批过程中应侧重药品的安全性,保障患者用药安全及用药知情权,体现医学伦理学的重要地位。第三,制定符合中国国情的同情用药申请标准、用药费用、相关的药品进口以及不良反应事件报告等制度;充分利用互联网资源,借助公共信息平台对符合条件的试验药物、患者疾病相关信息进行公布,同时定期发布药物的评价报告,以供更多的患者、医生及制药公司进行参考;同时,应尽量简化同情用药流程,使罕见病患者尽早用上药品,感受该制度的优越性。最后,将同情用药这种早期获取药物的途径与后续药品上市及医保报销政策相结合,通过缩短相应的审批时间可激励制药公司提供药物,让患有罕见病等迫切需要治疗药物的患者早日得到治疗。
目前,我国罕见病患者获得药品,可以通过基本医疗保险报销、地方大病报销或特殊报销政策、慈善捐赠或自费等方式。同情用药制度在中国的实施,无疑将为我国罕见病患者药物可及提供一种新途径,带来新的曙光。(作者单位:大连医科大学公共卫生学院;上海市罕见病防治基金会)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:申杨)
分享至
右键点击另存二维码!
-
为你推荐
-

以律为舟,谋定而后动—— 医药企业出海新兴市场的九大考量
全球医药市场格局正在重塑,我国医药企业依托创新积淀与成本优势,正以前所未有的规模和速度扬帆出海。全球新兴市场的巨大增量空间、资本青睐的国际合作契机,为我国医药企业出海开辟了价值跃升... 2026-01-27 09:10 -

依案说法|实际销售软件产品与注册证信息不一致,如何处罚?
2025年12月,A市药监部门依据《条例》第八十六条规定,对B公司生产经营与实际注册信息不符产品的行为,作出没收违法所得,并处罚款;并责令立即停止销售涉案产品,对已销售产品实施召回的处罚决... 2026-01-27 09:05
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有