2024年生物制药行业研发情况分析
- 2025-07-25 16:17
- 作者:
- 来源:中国医药报
2024年,全球生物制药行业在研发领域实现多维突破。投融资规模大幅增长至1020亿美元,连续第二年保持大幅增长。临床试验启动总数继2023年下降后回到2019年水平,为5318项,其中中国贡献了30%的份额;肿瘤与肥胖症治疗领域活跃。新药审批方面,全球共上市65种新型活性物质(NAS),高于过去十年的平均水平;难治疾病治疗模式取得重大进展
投融资金额连续增长
中国药企BD交易活跃
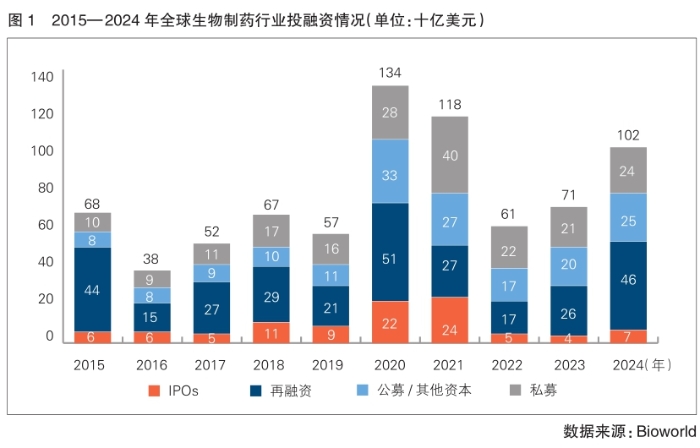
根据BioWorld发布的数据,2015—2024年全球生物制药行业投融资情况呈现显著波动。2024年的投融资规模从2023年的710亿美元上升至1020亿美元,使近五年的融资总额达到4860亿美元,与前五年的2820亿美元形成鲜明对比(详见图1)。2024年生物制药行业总体融资水平是过去十年中的第三高,仅次于2020年和2021年,并连续第二年保持了大幅提升。
2020—2024年,生物制药行业再融资金额累计达到1670亿美元,占该领域融资总额的34%。同时,再融资成为2024年最主要的融资类型,比2023年的260亿美元增长了77%,达460亿美元,占2024年生物制药行业融资总额的45%。
2024年,生物制药领域IPO总金额达到约70亿美元,超过2023年的40亿美元,但仍处于历史较低水平。私募融资、公募及其他融资持续超过新冠疫情前水平,分别为240亿美元和250亿美元。
从全球生物制药行业BD(商务拓展)交易活动来看,中国企业向跨国企业授权资产或被跨国企业收购的比例不断上升,在过去五年中达到92%。2024年,73宗国际并购或授权资产的交易中,有71宗涉及中国企业,其中多数是中国企业向美国或欧洲企业进行授权或被其收购。中国企业收购跨国企业或取得其资产授权的情况要少得多,这类交易通常来自那些渴望更多参与国际市场的中国企业。
在治疗领域,放射性药物和RNA疗法的交易量均有所增加。在2024年以中国为主的国际授权或并购交易中,有29宗交易与肿瘤治疗领域相关,其次是代谢/内分泌治疗领域;在金额超过20亿美元的27宗并购交易中,有9宗涉及肿瘤治疗领域;金额最大的一宗并购交易与肥胖症治疗相关;在其他治疗领域中,尚有大量交易细节未被披露。
临床试验数量下降
与2019年数据基本持平
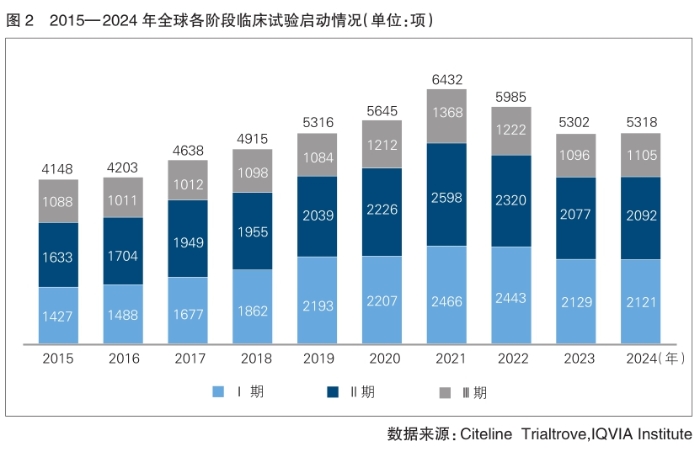
根据今年初Citeline Trialtrove发布的数据,2024年全球临床试验启动总数为5318项,继2023年下降后又恢复至2019年的水平(详见图2)。
从临床试验的不同阶段来看,2024年全球Ⅰ期临床试验比2019年有所减少,Ⅱ期和Ⅲ期临床试验相对较多,反映研发管线向中后期推进,部分环节效率可能提升。
从近十年数据来看,与2015年相比,2024年全球临床试验启动量增加1170项,但增长结构显著分化:Ⅰ期临床试验增幅达49%,Ⅱ期临床试验增长28%,而Ⅲ期临床试验仅微增1.6%。这一趋势凸显药物研发重心正向早期阶段转移。2021年,全球临床试验启动数达到近十年的峰值6432项,至2024年则逐步减少了1114项。其中,Ⅰ期临床试验启动数减少345项(14%),Ⅱ期临床试验减少506项(19%),Ⅲ期临床试验减少263项(19%)。
值得一提的是,2021至2024年全球临床试验减少量中,超过50%源于COVID-19相关研究的缩减。尽管当前COVID-19直接影响已趋缓,但历史性延误导致的试验启动或完成滞后,仍将持续影响企业研发进程,尤其对依赖外部融资的公司构成显著挑战。
从区域分布来看,尽管自2009年以来美国公司在全球临床试验启动中的份额总体有所下降,但其降幅远小于欧洲公司,且自2013年以来,美国公司在全球临床试验启动数量中一直占据最大份额。2024年,中国企业临床试验启动量在全球中的占比接近美国公司份额,而欧洲公司的份额则继续下降。这一趋势反映了中国在全球临床试验领域的迅速崛起。
具体而言,2024年,美国公司启动了1920项临床试验,占全球临床试验启动量的35%;中国公司启动了1669项临床试验,占全球启动量的30%;欧洲公司启动了1183项临床试验,占全球启动量的21%。尽管美国公司的份额有所下降,但其波动幅度明显小于欧洲公司,后者从2009年的44%下降至2024年的21%。同期,中国公司的份额从1%上升至30%,在过去十年中经历了一段快速增长期。
尽管小分子药物临床试验在新兴生物制药公司(EBP)中最为常见,但临床试验启动量的占比持续下降,尤其是Ⅱ期和Ⅲ期临床试验。2024年,EBP的临床试验启动量占比达到63%,高于2019年的56%,过去十年间,EBP在各临床试验阶段的数量已逐渐超过大型药企。
从具体领域来看,新型疗法,包括抗体偶联药物、多特异性抗体以及细胞和基因疗法,在2024年占肿瘤治疗领域临床试验启动量的32%。得益于即将商业化的EBP试验项目,细胞和基因疗法临床试验在过去十年间增长了两倍。在肥胖症治疗领域,从Ⅰ期临床试验到上市,肥胖症药物的研发管线现有173种药物,其中GLP-1及其组合疗法占主要份额,同时还有其他机制的药物。在神经治疗领域,过去五年中,阿尔茨海默病、抑郁症和帕金森病的临床试验启动数均超过200项;而2024年的数据表明,在肌萎缩侧索硬化症、多发性硬化症和肌肉萎缩症等其他领域,早期临床试验活动也有所增加。
值得关注的是,即便不将COVID-19相关临床试验计算在内,2024年传染病治疗领域临床试验的启动数量仍在持续下降。
NAS中国上市时间缩短
肿瘤治疗领域新药研发备受关注
2024年,全球共上市65种新型活性物质(NAS),这一数字高于过去十年的平均水平。中国企业在缩短全球与本土NAS上市时间差距方面取得了显著进展。
从治疗领域来看,2015—2024年,全球获批上市的NAS共634种。其中肿瘤治疗领域共有218种NAS获批上市,占比34%,排名第一,包括19种细胞和基因疗法,13种抗体偶联药物(ADC)以及12种双特异性抗体等创新机制药物。过去五年,内分泌、神经疾病和肿瘤治疗领域的新药上市数量有所增长,达到211种,而2015—2019年相关领域的新药上市数量仅为117种。
在2024年获批上市的48种NAS中,有16种是肿瘤领域治疗药物,8种是神经领域治疗药物,6种是血液领域治疗药物;胃肠道、内分泌和血液等治疗领域的新药上市数量有所增加。肿瘤治疗领域有10款首创新药获批,其中包括两种细胞疗法和三种双特异性抗体。在神经和胃肠治疗领域,2024年美国获批的新药中出现了30年来首个治疗精神分裂症的新机制药物,以及首个用于治疗代谢功能障碍相关脂肪性肝炎(MASH)的药物。在血液治疗领域,2024年上市了7种治疗血液疾病的NAS,其中包括3种基因疗法、1种B型血友病疗法、1种镰状细胞病(SCD)疗法,还有1种是治疗SCD和Beta型地中海贫血症,代表着这些难治疾病的治疗模式取得了重大进展。
另外,在2024年获批上市的药物中,超过75%是在其首次专利申请十多年后才获批上市的,从首次申请到上市的中位时间间隔为14年;而通过加速审批途径上市的药品,这一周期平均缩短了3.5年。
过去十年间,美国除了批准了509种NAS,还批准了1092项适应证扩展申请,其中小分子药物的获批数量和适应证扩展数量均多于生物制剂。
中国上市的NAS数量不断增加,从2020年到2024年,中国上市了188款NAS,与前五年相比增长了近50%。2019年,中国国家医保药品目录从之前的6到7年更新一次改为每年更新一次,创新药进入医保的周期显著缩短,加之药品审评审批制度改革优化部分创新药上市审批流程,一系列政策红利促使2019年之后跨国企业新药在中国的上市量激增。中国上市的新药不仅来自跨国企业,在2020年至2024年期间上市的188款中,有40%仅在中国上市,且全部由中国企业生产。
在中国上市的全球新药,其中位上市时间已从2005—2009年的9.6年显著降至2020—2024年的3.7年,这进一步激励了跨国企业积极在中国上市新药。在过去五年仅在中国上市的76款新药中,近60%为肿瘤治疗药物。
监管协调活动总体增加
临床开发生产力指数回升
2024年全球临床开发生产力指数(基于成功率、临床试验复杂度和临床试验时长的综合考量得出)呈现回升态势,这一改善得益于Ⅲ期临床试验成功率连续三年低位反弹,有效对冲了临床试验时长延长的压力,而临床试验复杂度整体维持动态平衡。
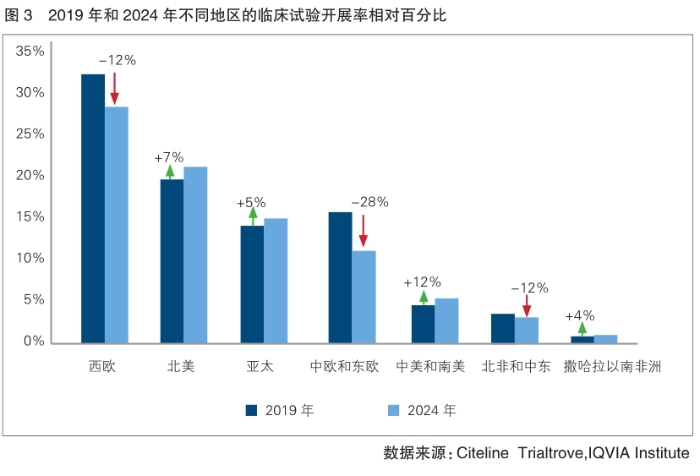
从区域角度看,2019—2024年,区域临床试验开展率呈现显著变化。西欧虽仍以28%的份额成为各地区临床试验开展率排行之首,但份额较2019年下降了12个百分点(详见图3)。北美相对份额自2019年以来增加7个百分点,仍居第二位。亚太地区以5%的增幅紧随其后。其中,中国的相对份额从2019年的9%增长至2024年的15%,增幅达66%。中欧和东欧地区的区域临床试验开展率降幅达28%,排名从2019年的第三位滑落至2024年的第四位。临床开发生产力形成新兴市场崛起与传统区域调整并存的格局。
从细分领域来看,过去十年,小分子药物临床试验成功率持续下降,而细胞与基因疗法成功率有所上升。2020—2024年的心血管领域临床试验成功率显著上升至15%,较2015—2019年的6%实现翻倍。临床试验复杂程度虽因招募标准与终点指标精细化而承压,但整体仍维持可控水平。
2024年,临床试验效率明显提升。2021—2023年持续延长的招募周期在2024年趋于稳定,这对肿瘤等长周期项目意义重大。临床试验项目间隔期从32个月的峰值,回落至17个月,开发总周期显著压缩。申办方也在运用各种手段提升整体生产力和生产效率。2022年至2024年,每年由AI公司启动的试验超过35项。新型临床试验设计应用率也从2023年的17%提升至19%,其中肿瘤治疗领域引领了这一趋势。压缩或合并试验等临床试验设计的优化,也成为缩短研发周期的重要手段。
尽管2024年全球各地监管机构仍存在差异,但大多数地区的临床开发监管环境相对稳定。中国持续推进ICH指南的实施,目前大部分已落实到位。
美国FDA起草了关于提高代表性不足人群入组率的指导方针,以帮助申办方满足“多样性行动计划”的要求。同时,更新了生物类似药相关指南,明确指出研究分析和临床数据可能足以证明产品的可替换性,无须进行特定的转换研究。
此外,韩国宣布上调审批费用以提升效率;欧盟虽探索流程简化,但上市许可与临床试验审批仍慢于美国;英国脱欧后规则差异增加监管复杂性;拉丁美洲的墨西哥实施了重大变革,以促进协调性与ICH接轨。
2024年监管协调活动总体增加,外部生态压力与效率提升手段并存,推动行业在可控复杂度下实现生产力突破。(艾昆纬供稿)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:曲雪洁)
分享至
右键点击另存二维码!
-
相关阅读
- 2019年重庆市政府工作报告
-
为你推荐
-

-
2024年生物制药行业研发情况分析
2024年,全球生物制药行业在研发领域实现多维突破。投融资规模大幅增长至1020亿美元,连续第二年保持大幅增长。临床试验启动总数继2023年下降后回到2019年水平,为5318项,其中中国贡献了30%的... 2025-07-25 16:17
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有