国家药监局2019年政府信息公开工作年度报告发布
- 2020-04-08 15:32
- 作者:
- 来源:国家药监局网站
日前,国家药监局网站发布《国家药品监督管理局2019年政府信息公开工作年度报告》。全文如下。
国家药品监督管理局2019年政府信息公开工作年度报告
根据《中华人民共和国政府信息公开条例》有关规定,编制本年度报告。报告内容包括总体情况、主动公开政府信息情况、收到和处理政府信息公开申请情况、政府信息公开行政复议和行政诉讼情况、信息公开工作存在的主要问题及改进情况等。本报告数据统计期限为2019年1月1日至2019年12月31日。
如对本报告有疑问,请与国家药品监督管理局综合和规划财务司联系(地址:北京市西城区展览路北露园1号;邮政编码:100037;咨询电话:010-88330707)。
一、总体情况
2019年,国家药品监督管理局高度重视政府信息公开工作,认真贯彻落实新修订实施的《政府信息公开条例》和《国务院办公厅关于印发2019年政务公开工作要点的通知》(国办发〔2019〕14号)要求,坚持统筹兼顾、突出重点,进一步强化制度建设,深化重点领域信息公开,加强政策解读宣传,不断提升药品监管信息公开的质量和实效。
(一)强化网站信息主动公开平台作用。2019年,我局网站主动公开政府信息4364条。其中:工作动态类信息397条,占9.1%;公告通告类信息2575条,占59%;科普类信息195条,占4.5%;法规文件类信息63条,占1.4%;政策解读类信息75条,占1.7%;专栏及综合管理类信息1037条,占23.8%;征求意见类信息22条,占0.5%。网站已建立70余个信息发布栏目、4个互动栏目,1个网上办事大厅。在清华大学“2019年中国政府网站绩效评估报告”中,我局网站名列部委政府网站第5名。
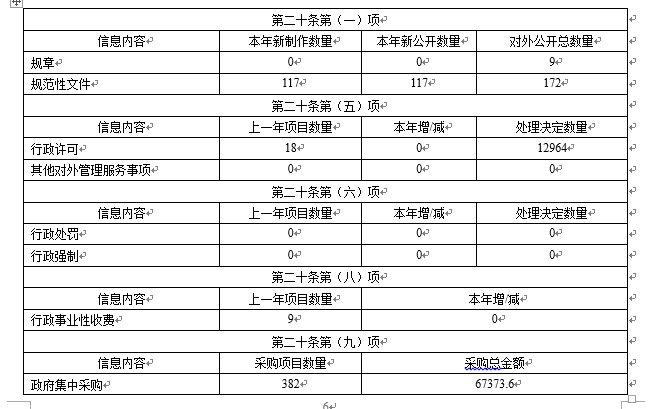
(二)加强制度建设和监管政策公开。制定发布《国家药品监督管理局政府信息主动公开基本目录》,及时更新我局政府信息公开指南,并在我局网站主动公开,方便公众获取信息。发布《关于进一步完善药品关联审评审批和监管工作有关事宜的公告》《关于向疫苗生产企业派驻检查员的指导意见》《药品质量抽查检验管理办法》等规范性文件。发布实施《疫苗追溯基本数据集》《疫苗追溯数据交换基本要求》等5项疫苗追溯标准。
(三)加强重点领域信息公开。
一是药品医疗器械审评审批信息公开。为便于行政相对人及时了解审评审批进度,药审中心网站可供行政相对人查询申报药品的审评审批进度信息。为保障公众用药安全,经国家局批准的药品审批信息均可在局网站数据库中供公众查询,数据库公布信息中含2019年经国家药监局批准的588个药品批准文号信息。持续推进上市药品目录集工作,2019年度共收录430个品规。2019年,通过局公告公布给予中药保护的品种6个、通过药物非临床研究质量管理规范认证机构8家、通过药品临床试验机构资格认定检查的机构256家。在局网站上主动公开医疗器械审评审批工作程序、标准和结果供公众查询,注册申请人可以查询审评审批进度。每月发布批准注册医疗器械产品公告,2019年共发布12份。每年发布年度医疗器械注册工作报告。器审中心对于创新、优先医疗器械技术审评报告予以公开,截止目前,已主动公开30份,进一步提升医疗器械审评审批透明度,全面接受社会监督。
二是化妆品审批备案信息公开。主动公开国家局审批的特殊用途化妆品和进口化妆品的批件信息,包括产品名称、企业名称和地址、产品类别、批准文号和有效期限、产品技术要求等项目,目前有效批件信息7万余件;主动公开国家局及承担进口非特殊用途化妆品备案工作的药品监督管理部门备案的进口非特殊用途化妆品信息,包括产品名称、企业名称、进口省份、备案资料核查情况等项目,目前备案产品1.8万余件;主动公开全国各省备案的国产非特殊用途化妆品产品信息,包括产品的名称、全成分、销售包装以及备案后检查结果等项目,目前备案产品160余万个。
三是药品医疗器械化妆品监督检查和抽检信息公开。组织完成药品191个品种16075批次样品的质量抽检工作,经检验不符合规定的241批次,发布不符合规定药品通告8期。发布23个药品补充检验方法。组织发布药物警戒快讯12期,发布2018年药品不良反应年度报告。根据已上市药品再评价结果组织对100余个品种进行修订说明书,对复方雪胆呋喃唑酮胶囊等4个品种进行撤市。发布医疗器械质量通告7期,医疗器械飞行检查停产通告8个。发布假冒化妆品通告9期,不合格化妆品通告10期,化妆品生产企业停产整改通告15期,化妆品生产企业飞行检查通报31个。
四是其他综合类管理信息公开。根据财政部统一安排,2019年4月2日,在我局网站发布国家药品监督管理局2019年部门预算,2019年政府采购情况一并公开。2019年,我局政府集中采购已备案项目数量382条,采购总金额67373.6万元。根据财政部要求,2018年原食品药品监管总局决算纳入市场监管总局,并于2019年7月19日在市场监管总局网站公开。稳步推进两会建议提案复文公开工作,选取部分代表委员高度关注,与人民群众密切相关,对于促进全系统药品监管工作有重要意义的复文,在与代表委员及相关部委充分沟通基础上,适时在我局网站公开。2019年,主动公开人大建议复文22件、政协提案复文18件。
(四)依申请公开工作情况。
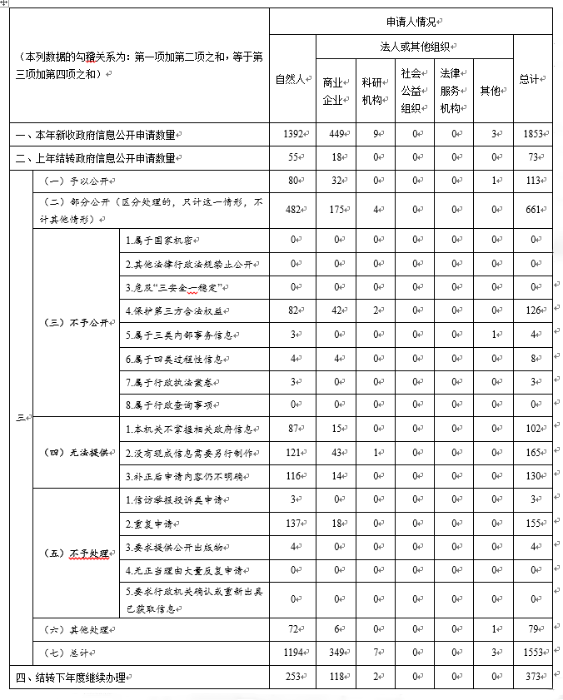
一是申请情况。2019年,新收到有效依申请公开事项1853件,其中,申请人为自然人1392件,占75.1%;申请人为商业企业449件,占24.2%;申请人为科研机构9件,占0.5%。从申请渠道来看,通过在线平台申请1585件,占85.5%;以信函形式申请225件,占12.1%;以传真形式申请31件,占1.7%;当面递交申请12件,占0.7%。
二是办理情况。1926件依申请公开事项中(含2018年结转依申请公开73件),予以公开113件,占6.9%;部分公开661件,占34.3%;不予公开141件,占7.3%,其中,保护第三方合法权益126件、属于三类内部事务信息4件、属于四类过程性信息8件、属于行政执法案卷3件;无法提供397件,占20.6%,其中,本机关不掌握相关政府信息102件、没有现成信息需要另行制作165件、补正后申请内容仍不明确130件;不予处理162件,占8.4%,其中,信访举报投诉类申请3件、重复申请155件、要求提供公开出版物4件;其他处理79件,占4.1%,主要是主动撤销或者咨询等;结转下年度继续办理373件,占19.4%,主要是在征求第三方意见。
(五)持续做好政策解读和科普宣传。一是围绕《进口药材管理办法》、医疗器械注册电子申报等重点工作组织开展各类新闻发布活动,展现监管部门工作成效,及时传递权威声音,引导公众科学认知药品监管工作。2019年共组织新闻发布会(含通气会、见面会等)8次。二是积极组织媒体开展专访工作,带领媒体走进中检院、评价中心、器审中心,深入了解报道药品医疗器械审评审批制度改革工作。三是依托“学习强国”学习平台搭建“健康中国”专题板块,开展药品安全政策解读和科普宣传,提供科普视频111个、政策图解66个、药品科普图文100条、疫苗科普系列作品等内容。四是开展以“安全用药 良法善治”为主题的“全国安全用药月”科普活动,活动围绕宣贯《药品管理法》《疫苗管理法》、加强药品审评审批制度改革、药品安全科普宣传和公众开放日等活动开展,组织主流媒体开展正面宣传报道,有效提升公众安全用药意识,推动药品安全共治。据统计,安全用药月活动期间,共开展安全用药科普宣教活动9157场次,发放宣传资料677.14万份,通过媒体传播覆盖公众逾2.66亿人次。
(六)加强新媒体平台建设,提升信息发布能力。加强我局政务微信、微博等新媒体的信息发布能力建设,与局网站同步推送重要监管工作信息、重大会议内容和重点政策解读。2019年微信公众号“中国药闻”共发布文章672篇,粉丝量已达48.3万人,文章总阅读数达430万余人次;政务微博“中国药品监管”共推送文章653篇,文章总阅读数达到1900万余人次。此外,今日头条号“中国药闻”推送文章477篇,人民号“中国药闻”推送文章370篇,进一步拓宽信息发布渠道,增加人群覆盖面。
二、主动公开政府信息情况
三、收到和处理政府信息公开申请情况
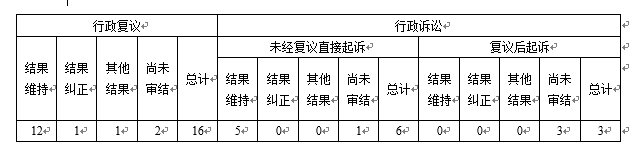
四、政府信息公开行政复议、行政诉讼情况
五、存在的主要问题及改进情况
2019年,我局信息公开工作虽然取得了明显成效,但面对新修订《政府信息公开条例》实施以来的新情况,面对药品监管工作的新形势新任务,面对公众对药品监管信息公开日益迫切的新需求,我局信息公开工作仍存在一些问题和不足。一是主动公开力度仍需进一步加大,政策解读实效要进一步提升。二是信息公开平台建设要进一步提升和完善。三是信息公开工作的能力建设要持续加强和推进。
2020年,我局将全面贯彻党的十九大和十九届二中、三中、四中全会精神,严格按照《政府信息公开条例》和国务院有关要求,重点做好以下工作:
(一)加大主动公开力度。深入落实《政府信息公开条例》,推进审评审批、监督检查、案件查办等重点信息主动公开,全面推进阳光监管。针对重大政策措施出台,及时开展政策宣传解读,提升政策传播实效。
(二)加强信息公开平台建设。继续优化完善我局网站栏目设置和应用功能,发挥公开主渠道作用,增强检索、下载等功能实用性,提高用户友好度,更好地满足公众获取药品监管信息的需求。
(三)持续推进信息公开能力建设。对新条例实施以来面对的新情况新问题,加强调查研究和梳理分析,多总结多思考,不断规范完善申请办理的机制程序,提高办理能力和水平。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐
-

-

互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有










