《药品注册管理办法》学与践 | 带您快速了解药品加快上市注册程序
- 2020-07-27 17:26
- 作者:佟路 王海辉
- 来源:中国食品药品网
近年来,药品医疗器械审评审批制度的改革对促进产业快速健康发展起到了非常积极的作用,一系列新制度的建立和完善,使得创新药全球同步研发成为可能,同时切实加快了药品上市注册速度,缩短了境内外同产品上市的时间差,使得中国患者能够早日受益于先进的治疗手段。
2020年3月30日,国家市场监督管理总局公布了新修订《药品注册管理办法》,于2020年7月1日起正式实施。《药品注册管理办法》不但总结了近年来的改革成果,更为进一步贯彻落实新版《药品管理法》起到了承上启下的作用。
新修订《药品注册管理办法》特别设立了第四章“药品加快上市注册程序”,其中的四个小节分别对突破性治疗药物程序、附条件批准程序、优先审评审批程序和特别审批程序进行了原则性的规定。随后,为了配合《药品注册管理办法》的实施,国家药品监督管理局在7月8日发布了《突破性治疗药物审评工作程序(试行)》《药品附条件批准上市申请审评审批工作程序(试行)》《药品上市许可优先审评审批工作程序(试行)》三个文件。国家药监局药审中心为落实上述三个文件的要求,于7月9日发布通知,明确了已开通“突破性治疗药物程序申请系统”和新版“优先审评审批申请系统”的电子提交通道。
本文对《药品注册管理办法》及相关文件中关于药品加快上市注册程序的要求进行了总结,并简要介绍了美国FDA加快审批制度体系,希望通过对政策的梳理和浅析,能够为我国进一步落实和完善药品加快上市注册程序提供参考。
我国药品加快上市注册程序
突破性治疗药物程序
突破性治疗药物程序是《药品注册管理办法》新设立的加快上市注册程序,旨在鼓励研究和创制具有明显临床优势的药物。申请人可在临床试验期间(通常不晚于III期临床试验开展前),针对用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等情况,申请适用突破性治疗药物程序。
1.申请程序
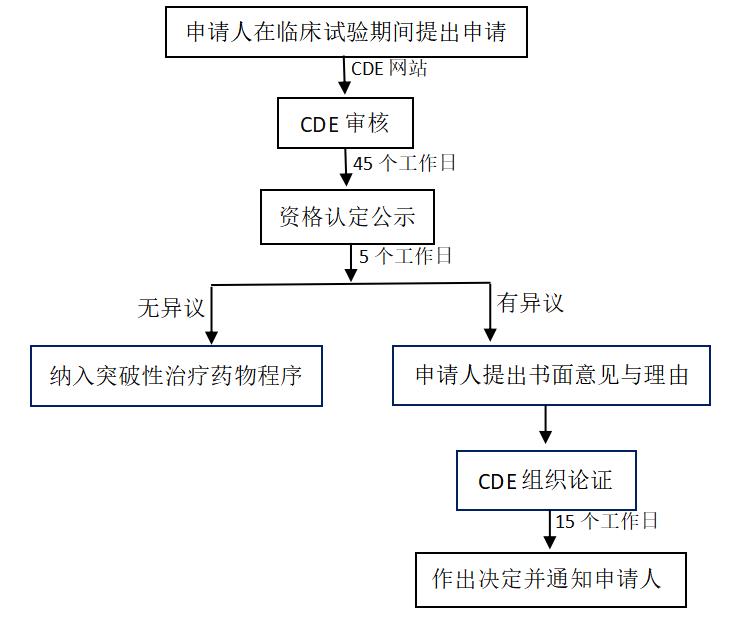
2.政策支持
申请人可以在药物临床试验的关键阶段向CDE提出沟通交流申请,CDE安排审评人员进行沟通交流。
申请人可以将阶段性研究资料提交CDE,CDE基于已有研究资料,对下一步研究方案提出意见或者建议,并反馈给申请人。
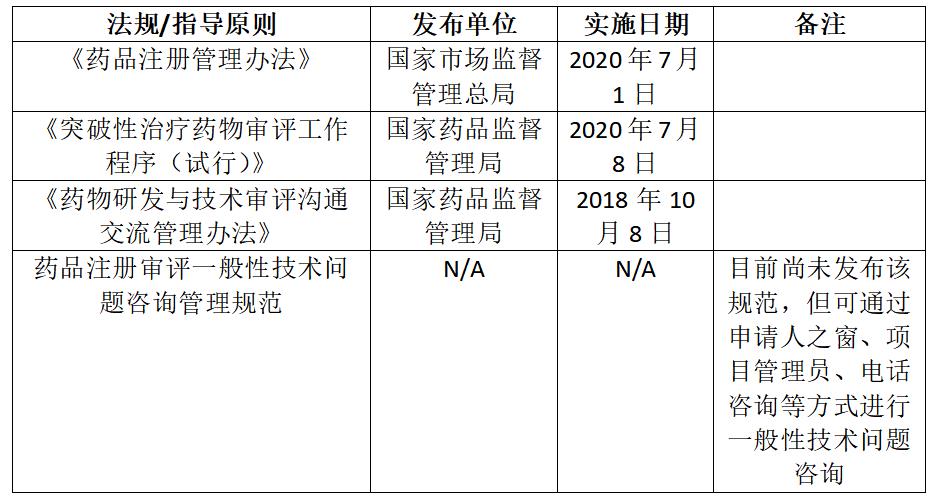
3.突破性治疗药物程序相关政策总结
表1.3
附条件批准程序
附条件批准程序也是《药品注册管理办法》中新明确的加快上市注册程序,旨在加快具有突出临床价值的临床急需药品上市。根据CDE于7月9日发布的通知,与突破性治疗药物程序和优先审评审批程序不同的是,附条件批准上市申请应按要求在提交药品上市许可申请时一并提交纸质申请表,不涉及电子提交通道。另外需要注意的是,目前发布的工作程序中指出,“附条件批准上市审评审批的具体技术要求参照《药品附条件批准上市技术指导原则》(以下简称附条件批准技术指南)等执行”,而附条件批准的技术指南尚未发布,所以需要持续关注。
1.工作程序
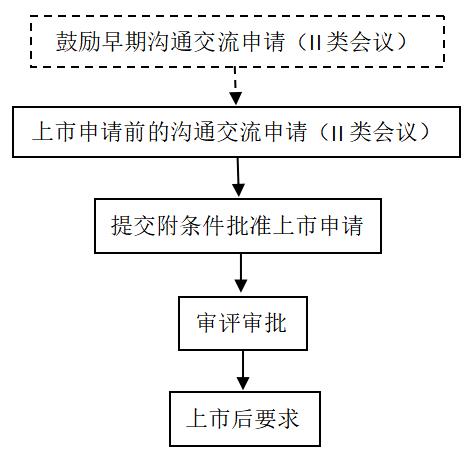
2.上市后要求
附条件批准的药品上市注册证书中会载明有效期和上市后需要继续完成的研究工作及完成时限等相关事项。上市许可持有人应当在药品上市后采取相应的风险管理措施,并在规定期限内按照要求完成相关研究并提交补充申请,补充申请审评通过的,换发有效期为5年的药品注册证书,药品注册证书有效期从上市申请批准之日起算。
如药品上市许可持有人提交的上市后研究不能证明其获益大于风险的,或逾期未按照要求完成研究并提交补充申请的,其药品注册证书将被按程序注销。
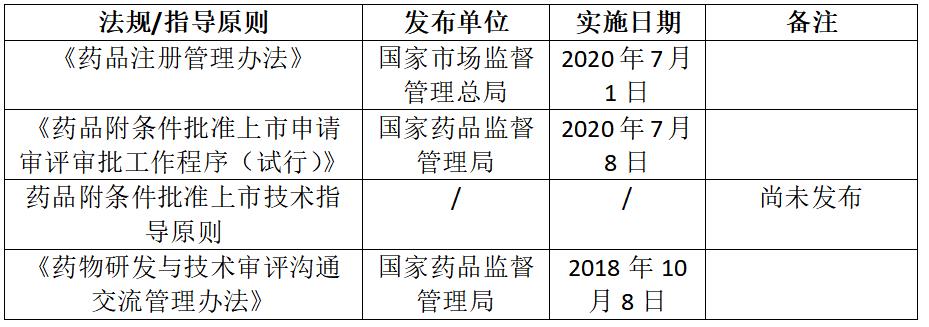
3.附条件批准程序相关政策总结
表2.3
优先审评审批程序
优先审评审批程序的首次建立是在2016年,并在2017年进行了一次修订。作为药品审评审批体系改革的一大亮点,这一制度有效地解决了在审评积压的大环境下如何加快危及生命的、具有临床优势的、临床急需的药物的审评审批。随着审评任务积压问题得到解决,监管体系不断完善,本次优先审评审批程序在范围上进行了较大调整,删除了特定疾病和治疗领域,将范围进一步明确至:短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药;儿童用药新品种、剂型和规格;疾病预防、控制急需的疫苗和创新疫苗;纳入突破性治疗药物程序的药品;符合附条件批准的药品等。
1.申请程序
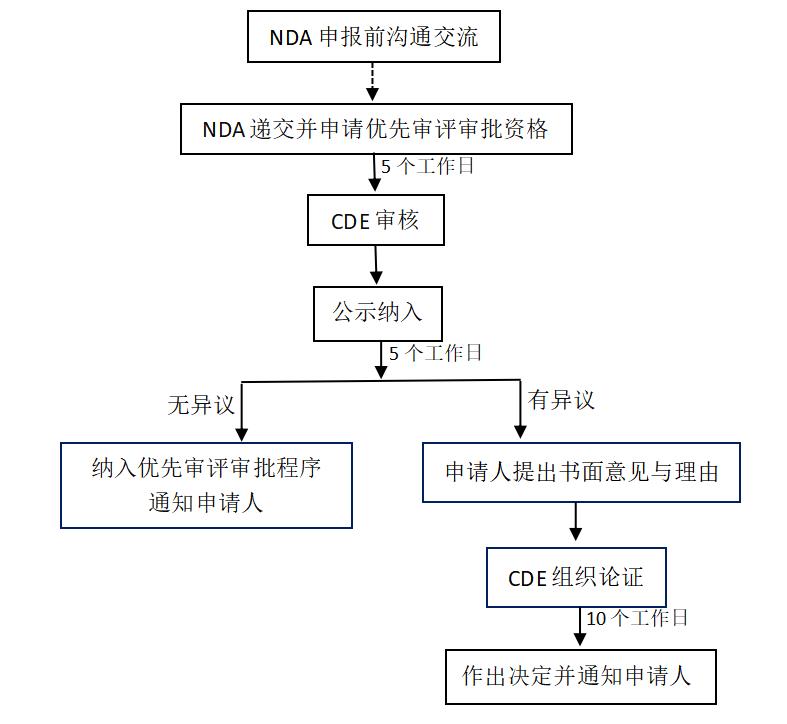
2.政策支持
优先审评审批程序的政策优待主要来自于审评时限的缩短。根据《药品注册管理办法》时限的相关规定,纳入优先审评审批程序的申请其审评时限将由200个工作日缩短至130个工作日。对于纳入优先审评审批程序的临床急需的罕见病药物,审评时限将缩短至70个工作日。
3.优先审评审批程序相关政策总结
表3.3
特别审批程序
《药品特别审批程序》由原国家食品药品监督管理局在2005年11月发布并实施,这是一种特殊的加快审批程序,旨在有效预防、及时控制和消除突发公共卫生事件的危害,保障公众身体健康。
1.申请程序
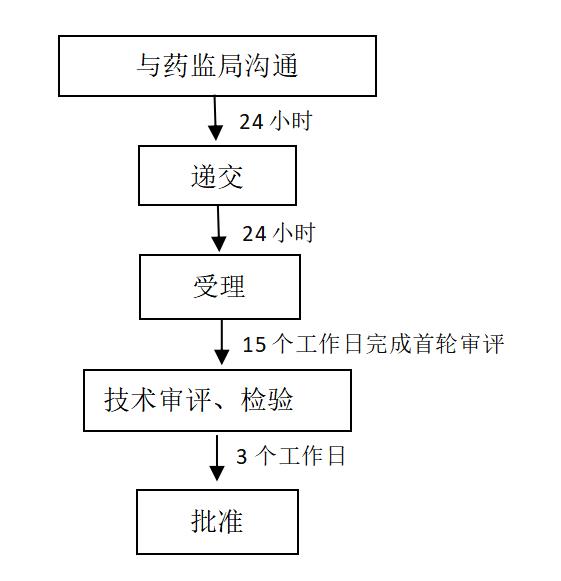
2.特别审批程序相关政策总结
表4.2

美国FDA加快审批制度体系简介
美国FDA的加快审批制度共有四种:(1)突破性疗法;(2)快速通道;(3)加速审批;(4)优先审评。罕见病药品认定(可适用于治疗罕见疾病和症状的药品)通常不认为是加快审批制度,因为其不改变获得上市批准的标准监管要求、程序或时长(尽管许多罕见病药品同时也适用优先审评制度)。但它也同时有某些鼓励政策,如税收抵免和市场独占期等。
下图总结了FDA四项加快审批制度的主要标准条件及相关特殊待遇。在下图中(见图1),实线箭头指相关加快审批制度正式包含的鼓励措施,虚线箭头指符合加快审批制度资格要求的产品通常也可享受该特殊待遇,但必须单独达到该特殊待遇的资格要求。
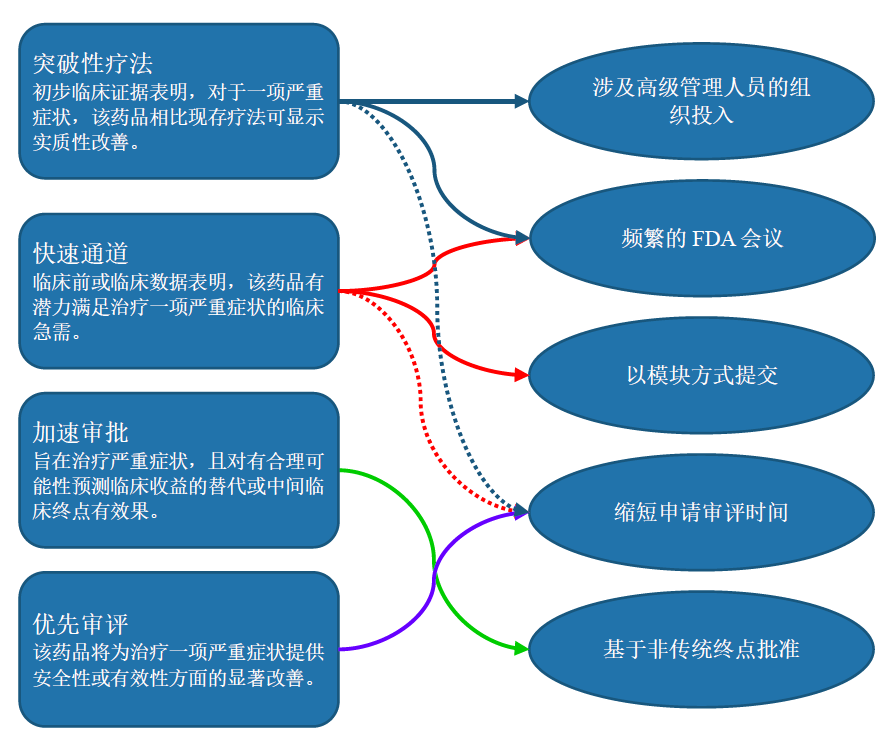
图1
目前,我国已建立起相对完善的药品审评审批程序和制度,对于严重危及生命且无有效治疗手段及有明显临床优势的药品,通过给予指导、加快研发进程、加速上市申请的审评等方式,帮助加快药品上市注册程序。笔者希望,随着我国药品审评审批制度改革的不断深入,在不断优化和完善上市注册程序的同时,考虑建立专门针对创新疫苗和新科技、新技术(如细胞治疗、基因治疗等)、罕见病用药的加快程序。此外,要实现创新药的全球同步研发和加快上市进程,还需要各有关部门的共同努力,比如优化和加快伦理审查程序等,从序贯审查变为平行审查,在整体上优化我国药物研发监管审查的程序。建议考虑接受更符合科学研发规律的早期研究资料,并注重知识产权保护相关政策的配套衔接等。期待通过各方的不断努力,推动我国的药品加快上市注册程序不断完善。(佟路 王海辉 辉瑞投资有限公司)
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐













