一文了解中外新药上市的“加速通道”
- 2020-11-17 16:05
- 作者:付珊珊 寇壬花 周韶华
- 来源:中国食品药品网
新修订《药品注册管理办法》(以下简称新《办法》)为新药上市开辟了四大“加速通道”:突破性治疗药物程序、附条件批准上市程序、优先审评审批程序和特别审批程序。随着新《办法》的正式实施,2020年7月8日,国家药监局发布了《突破性治疗药物审评工作程序(试行)》等三个文件的公告,突破性治疗药物、附条件批准上市、优先审评审批三大“加速通道”的相关程序和要求于发布之日起正式实施。这是国家药监局鼓励新药创制又一里程碑式的举措,旨在鼓励以临床价值为导向的药物创新,加快急需药品上市,解决未满足的临床需求,这也极大地激励了企业研发创新的热情,对中国制药行业将产生积极深远的影响,亦将最终惠及更多患者。
我国新药“加速通道”
近年来我国创新药研发势头强劲,国家药监局药审中心(CDE)公开数据显示,2019年CDE共受理国产1类创新药注册申请528件(244个品种),1类进口创新药注册申请172件(75个品种)。为鼓励真正具有临床价值的创新药研发,我国设立了新药上市的“加速通道”,这对申请人来说无疑是重大利好。但需要注意的是,这些“加速通道”也有相应的申请条件,对于申请人来说是机遇与挑战并存。
突破性治疗药物程序
突破性治疗药物程序的设立,使审评人员在临床早期阶段通过与申请人密切沟通交流来指导并加速药物研发。
对于用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段、或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等,申请人可以在Ⅰ、Ⅱ期临床试验阶段,通常不晚于Ⅲ期临床试验开展前,提出该申请。
纳入突破性治疗药物程序的,CDE将优先配置资源与申请人进行密切的沟通交流,探讨更灵活的研发策略,缩短临床研发周期,加速药物上市,另外在上市申请时可直接被授予优先审评的资格。
但需要指出的是,获得突破性治疗药物程序认定的,并不意味着通往上市的路上将一路绿灯,而是会进行实时动态评估。按照相关规定,当新的临床试验数据不再显示比现有治疗手段具有明显临床优势或因重大安全性问题终止临床试验的,突破性药物程序的资格将被终止。
优先审评审批程序
药品上市申请,以下具有明显临床价值的药品,可以申请适用优先审评审批程序:(一)临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药;(二)符合儿童生理特征的儿童用药品新品种、剂型和规格;(三)疾病预防、控制急需的疫苗和创新疫苗;(四)纳入突破性治疗药物程序的药品;(五)符合附条件批准的药品;(六)国家药品监督管理局规定其他优先审评审批的情形。
与之前的工作程序(《总局关于鼓励药品创新实行优先审评审批的意见》(2017)(以下简称《意见》))相比,《药品上市许可优先审评审批工作程序(试行)》(以下简称《程序》)优化了申报路径,提升了工作效率。该文件规定,申请人应在上市前沟通交流会上就是否符合优先审评审批程序纳入条件进行探讨,初步确认可纳入优先审评程序的,在会议纪要中予以明确。申请人在提出上市申请的同时提出优先审评审批申请,CDE应当在收到申请后5日内进行审核并反馈申请人,拟纳入优先审评审批程序的,在药审中心网站予以公示。
对于纳入优先审评审批程序的药品,CDE将优先配置资源进行审评,目标审评时限大幅缩短。上市许可申请的审评时限由标准时限200个工作日缩短到130个工作日,其中临床急需的境外已上市境内未上市的罕见病药品审评时限为70个工作日。另外,在技术审评过程中,经与CDE沟通交流确认的,申请人可以按要求补充提交相应技术资料,审评时限不延长。
需要注意的是,以上范围的药品,除了纳入突破性治疗药物程序及符合附条件批准的药品,其他药品还应满足相关条件:临床急需的短缺药品应列入国家卫健委等部门发布的《国家短缺药品清单》,重大传染病应当由国家卫健委认定,罕见病应列入国家卫健委等部门联合发布的罕见病目录,对于疾病预防、控制的急需疫苗也由国家卫健委和工信部门提出,儿童用药按照新品种、新剂型和新规格也设立了具体的条件。与《意见》相比,《程序》更强调临床价值和解决临床需求,如未在中国境内上市销售的创新药、转移到中国境内生产创新药、先进制剂技术,专利到期前1年的生产申请;中美欧共线产品、列入重大专项的药品均未列在新的优先审评审批程序范围内;另外删除了按疾病划分的范围,包括艾滋病、肺结核、病毒性肝炎、罕见病、恶性肿瘤、儿童用药品、老年人特有和多发的疾病等。
附条件批准上市程序
附条件批准上市程序首次在中国正式实施。按照相关规定,药物临床试验期间,符合以下情形的药品,可以申请附条件批准:(一)治疗严重危及生命且尚无有效治疗手段的疾病的药品,药物临床试验已有数据证实疗效并能预测其临床价值的;(二)公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的;(三)应对重大突发公共卫生事件急需的疫苗或者国家卫生健康委员会认定急需的其他疫苗,经评估获益大于风险的。
获得附条件批准的,申请人可利用替代终点或中间临床终点提交上市申请,将大大缩短产品上市的时间。
值得注意的是,申请人需要按照承诺在规定时限内完成药物临床试验等相关研究,以补充申请方式申报。审评通过的,换发有效期为5年的药品注册证,逾期未按照要求完成研究并提交补充申请,没有合理理由的,按照文件要求,国家药监局将按程序注销其药品注册证书。
欧美新药“加速通道“
美国及欧盟也有类似的“加速通道“,且已实施多年,对我们有一定的借鉴和指导意义。
突破性治疗药物程序
美国于2012年将突破性疗法认定(Breakthrough Therapy Designation (BTD))纳入到《美国食品药品管理局安全和创新法案》(FDASIA), “欧洲版BTD“程序优先药物计划(Priority Medicine, PRIME)于2016年推出,旨在从临床早期阶段加速对临床急需新药的审评进程。中国BTD的认定条件,申请人获益等与欧美总体相似,申报程序略有差异,对比分析见图1。
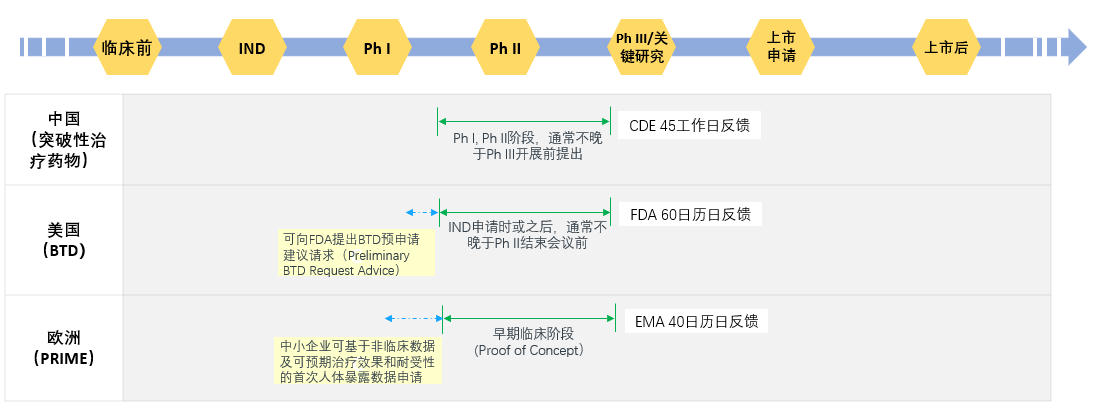
图1 中美欧突破性治疗药物申请程序对比
统计数据显示,截至2020年9月30日,美国FDA共收到1042个BTD申请,其中383个药品获得BTD认定,179个药品获批上市。BTD药物的上市审批时间平均缩短约3个月,与未获得BTD认定的药物相比临床开发时间缩短2-3年。这离不开FDA在BTD申请前给予的科学建议及获得BTD认定后提供的密集研发指导。
我国突破性治疗药物的申请同样踊跃。据CDE专家在2020年CSCO大会上介绍,截至2020年9月10日,仅实施两个月CDE就收到了87个突破性治疗申请,其中包括64个肿瘤产品,4个申请已被正式纳入。截至10月20日,已有8个申请被纳入。这让人担心未来BTD通道是否会出现“塞车“现象。因此,笔者建议,CDE可以从一开始就考虑介入指导,比如可参考FDA提供初步BTD申请建议(Preliminary BTD Request Advice)的方法:申请人可向FDA提出预申请BTD建议请求,FDA根据申请人提供的预申请表,包括产品机制、适应症背景、现有治疗手段及初步临床证据等信息,提供该药品是否能够申报BTD或是否达到认定条件等建议,引导申请人合理申报;根据积累的经验发布申报技术指南或电子刊物等,明确申报要求(如FDA发布的《FDA行业指南:严重疾病加快程序-药物和生物制剂(2014)》(FDA Guidance for Industry: Expedited Programs for Serious Conditions - Drugs and Biologics (2014),EMA发布的《申请人申报进入优先药物程序指南》(European Medicines Agency Guidance for applicants seeking access to PRIME scheme)均对纳入的要求及程序进行了详细的说明)。另外,也期待CDE多通过行业会议等途径公开介绍审评考虑及建议,给申请人更多的借鉴和参考。而作为申报主体,申请人应在申报前从适应症疾病细分与背景、产品作用机制、临床优势,数据稳健性等方面进行评估,平衡速度与质量。
优先审评审批程序
根据《处方药使用者法案》(PDUFA),为达到加快药品审评的目的, FDA于1992年创建了标准审评(Standard Review) 和优先审评(Priority Review)。欧洲版“优先审评审批”程序命名为Accelerated Assessment procedures(加速审评程序)。相较于中国非常具体的认定条件,FDA及EMA的条件比较宽泛,FDA的认定条件为治疗严重疾病且显著改善安全性和有效性的药品,按照505a依据儿童临床试验修改说明书,治疗特定感染性疾病或递交时有优先审评券的;EMA只强调为公共卫生方面临床急需药品,可带来一种新的治疗方法或较现有治疗方法有明显改善从而显著解决未满足的临床需求。总体上,中美欧程序类似,均致力于缩短审评时限,加速“有明显临床价值的”药品上市。申报程序上略有差异,中美欧对比分析见图2。
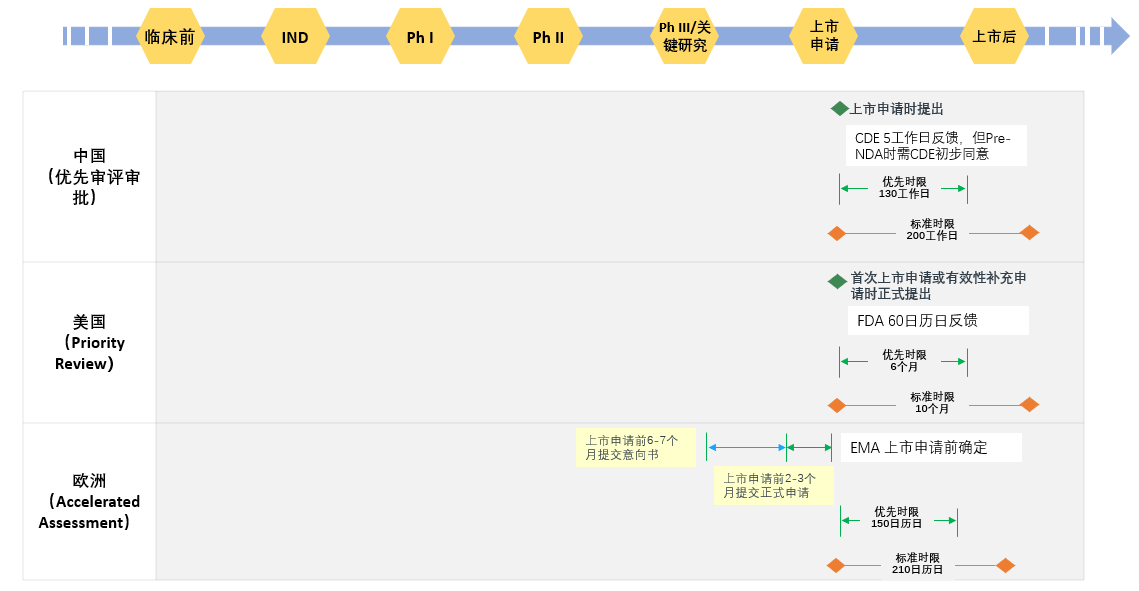
图2 中美欧优先审评审批申报程序对比
根据公开数据统计,2019年FDA共批准126个NDA及BLA申请,49个获得优先审评审批。其中创新药共有48个,28个获得优先审评资格,所有优先审评的药品均在8个月以内获得批准(相对于平均标准时限约需12个月)。我国纳入优先审评程序后,审评时限与FDA相当,由此也可以看出中国药品监管机构加速有临床价值新药上市的决心与信心。从纳入条件看,中国设定的范围更严格具体,除儿童用药外,其他范围药品应具备“先决”条件,即应满足至少一项下列条件,即获得突破性认定,满足附条件批准,列入罕见病目录、短缺药品目录、临床急需的境外已上市境内未上市的罕见病药品目录、急需疫苗目录,这些先决条件可以使申请人进行更好的自我判定,并且节约审评资源,但也可能会使一些好药错失加速上市的机会。因此,笔者希望CDE可以在审评或药品临床开发的过程中主动向申请人提议申请突破性认定或附条件批准上市,同时也希望相关部门形成更好的联动,建立罕见病、临床急需、短缺药等目录的动态更新机制,指导和优化申请人申报纳入路径。
附条件批准上市程序
相对于中国附条件批准程序,美国称为加速批准程序(Accelerated Approval)。该程序始创于1992年,后于2012年通过《FDA安全与创新法案》(FDASIA) section 901进行修订。欧盟附条件批准程序(Conditional Approval)于2006年设立。中美欧均旨在通过该程序同意采用替代终点(surrogate endpoint)或中间临床终点(intermediate clinical endpoint)来加速重大疾病药物的上市批准;纳入条件均强调治疗严重危及生命有显著临床优势的药品且已有临床数据可显示疗效并能预测临床获益。申报程序及上市后规定略有差异,对比分析见图3。
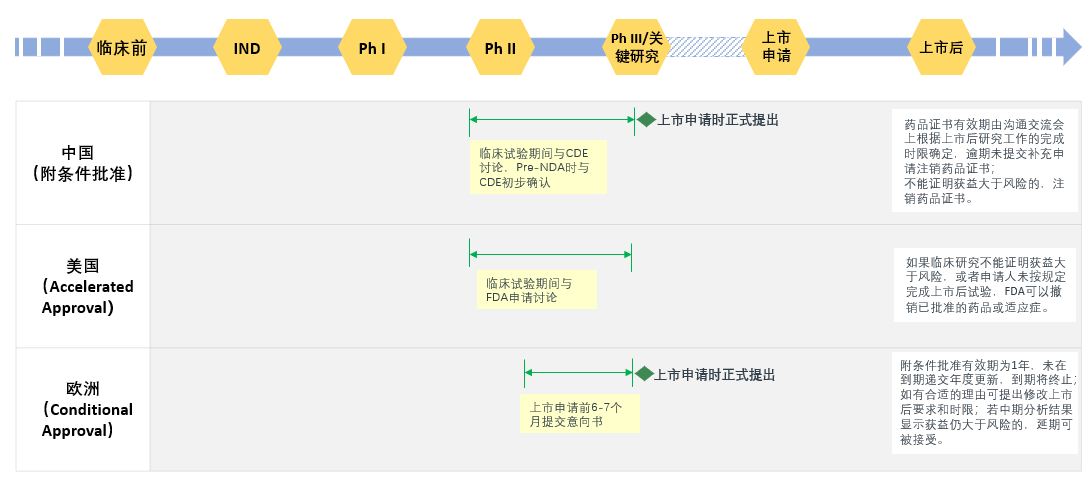
图3 中美欧附条件批准上市程序对比
FDA对替代终点和中间终点进行了定义。替代终点是指能预测临床效益的实验室指标、放射影像、体征或其他指标,但其本身并不是临床终点指标。同样的,中间终点也是一种治疗效果的衡量,可能预测药物的临床获益,如对不可逆发病率和死亡率的影响。
EMA规定如果快速获得的数据可预测获益大于风险且满足相应的条件,申请人可以基于尚不全面的( less comprehensive)临床数据递交附条件上市申请。申请人应对中间临床终点的适用性、预测临床获益的能力进行讨论。EMA也特别说明,如果中间临床终点是经过验证的替代终点,将不需要更多的实际临床获益的数据,特定的上市后责任也将不再要求。
附条件批准上市可显著提高药物的可获得性,比如帕博利珠单抗(Keytruda)在美国的上市,不同适应症约提早上市1-3年。目前中国附条件批准上市相关技术指导原则已完成一次征求意见,尚未正式落地,期待附条件批准上市的纳入条件、替代终点及中间临床终点的定义、沟通交流中应呈现及解决的问题、提出上市申请的数据要求、上市后临床研究等技术相关的建议及考虑可以在最终稿中体现,以便更清楚地引导和指导申请人申报。对于上市后研究,考虑到一些确证性临床研究需要较长时间完成,因此建议申请人在与CDE的沟通交流中做好详尽的计划,制定合理的完成时限,尤其是上市后临床研究可能长于再注册前剩余时间的情况,应特别提出从而与CDE一起确定并在批件注明预计完成的时间,定期给监管机构的报告周期和途径,提前规避再注册时上市后研究不能完成可能面临的挑战;对于情况较复杂特殊的,如果申请人能提供合理理由而被允许延长期限,或许能更有利于临床研究高质量地开展。另外,笔者希望CDE能考虑接受多途径的临床有效性及安全性证据,如接受真实世界数据;对于治疗严重危及生命且尚无有效治疗手段疾病的新药或者罕见病用药,单臂研究批准上市后可不再进行确证性临床研究等方式,来进一步鼓励创新、科学的研发策略,节省医疗资源。
中国的新药上市“加速通道“,既参考了他山之石又考虑了既往经验和中国国情,相信经过一定时间的运行,各类加速程序将有力助推中国创新能力的提高。(付珊珊 寇壬花 周韶华 百济神州)
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐













