生物制药产业:高速增长背后面临“成长期”挑战
- 2020-11-24 17:28
- 作者:
- 来源:RDPAC
生物制药产业作为我国的战略性新兴产业,是“健康中国”的重要支撑。加快生物制药产业发展既是推动经济增长的驱动力,也是实现关键技术创新的突破口,更是守护广大人民群众长期健康的“生命线”。
近日,药品安全合作联盟(PSM)、中国外商投资企业协会药品研制和开发行业委员会(RDPAC)等13家协会、学会联合在京发布《中国抗体药产业健康发展报告》,总结了我国抗体药产业的发展现状、政策环境、主要挑战、国际经验和优化建议等。
中国生物制药产业如初升旭日
从全球生物制药产业发展来看,我国生物制药产业起步较晚但增速较快,市场潜力较大。2014~2019年,我国生物制药产业市场规模从1167亿元增长至3172亿元,占全球市场的16%,年均增速22%, 超过8.8%的全球同期增速。与此同时,作为原研生物制品的补充,我国的生物类似药市场呈现出典型的发展中国家特征:市场占比逐年提高,市场规模快速扩张(预计2023年底增至200亿元规模),年均增速保持高位(预计未来3年CAGR~60%)。
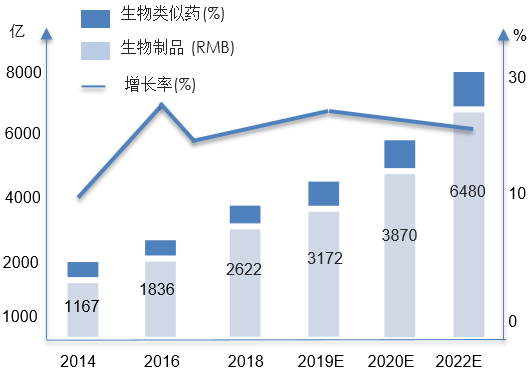
图1. 2014~2022年中国生物制药产业市场规模及增速(亿元人民币, %)
数据来源:Wind 数据库
然而,在高速增长的数字背后,我国生物制药发展也面临着产业“成长期”特有的挑战。
首先,研发管线数量全球领先,但创新能力不足。2019年,我国生物制品(包含生物类似药)研发管线总数高达391,位居全球第一;其中生物类似药251个,占比64%;从生物制药产业发展较成熟的国际水平来看,除我国外,多数国家生物类似物在生物制品占比不超过53%,而我国明显高于该水平。此外,我国生物制药产业研发管线拥堵,呈现出“高总量,同质化”的特征,因此我国生物制药产业需实现长期、稳定、高质量的发展。
第二,整体产能偏低,规模扩张仍需时日。现阶段,我国在生物制药领域的核心技术(如细胞培养、纯化工艺等)和人才能力仍有待提升,产业发展的核心能力依然落后于发达国家,面临着依赖进口、成本高启、产能受限等多重压力,短期内难以实现产能扩张。总量上看,2018年全球生物制品企业总产能超过1670万升,其中,北美地区占比36.1%,欧洲占比32.9%,而中国生物制品总产能仅86万升,占全球总产能的5.2%。
表1. 2018年全球各主要国家和地区生物制品产能对比
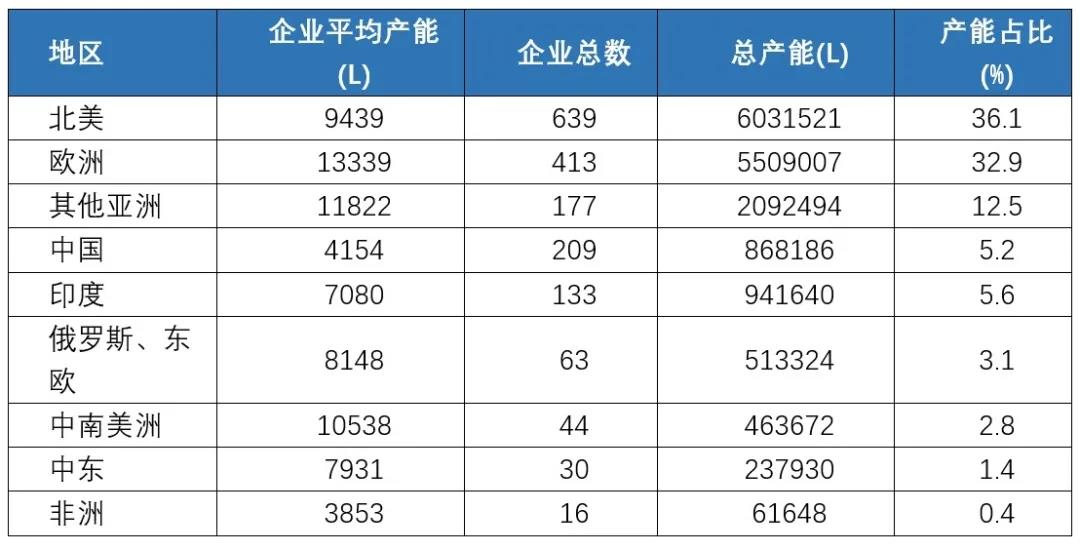
数据来源:Rader and Langer, 2018
值得关注的是,生物制品市场渗透率低,产业生态仍需完善。在我国,生物医药的临床应用有限。例如,仅有20%~25%的新诊断乳腺癌患者,少于10%的结直肠癌患者,小于5%的类风湿关节炎患者使用生物制品治疗。而美国的同项占比分别为70%、55%和25%。从2017年开始,伴随境外临床急需新药的不断引入,以及我国本土创新企业的逐步发展,创新生物制品的可获得性得到了满足。但是,由于临床使用经验有限,医生及患者对生物制品的认知和使用还在不断提高中,助力生物制药产业链条的研发、生产、使用等各环节发展的生态体系仍需完善。
中国生物制药产业仍在发展初期
在保证药品质量一致性的前提下,国家对临床用量大、采购金额高、竞争充分的化学药品,通过带量采购政策,在降低药品价格、提高行业集中度等方面取得显著成效。生物制品是否适合带量采购也是各界共同关心的话题。根据国家医保局官方消息,在考虑生物类似药的相似性、企业产能和供应链的稳定性、具体产品的临床可替代性三个基本条件的基础上,将适时开展集中带量采购。
首先,相似性方面。生物类似药与原研生物制品的差异可能影响治疗效果,结构差异对其药代动力学、疗效和安全性均产生影响;即使结构相同,由于糖基化模式等因素的不同,也会影响治疗效果。为此,国际上各国监管部门均制定了严格的生物类似药相似性审评审批的法规框架。近年,伴随我国药品审评审批制度改革,国家药监部门陆续发布了多项法规文件,明确生物类似药的定位及审评技术指导原则,自2015年试行的生物类似药研发与评价技术指导原则发布后的第4年(2019年)批准了我国首个生物类似药。可见,我国生物制药产业尚处于从“婴儿期”向“成长期”过渡的关键发展阶段,亟需一个稳定的政策环境助力产业发展。
其次,企业产能和供应链的稳定性方面。如前所述,以抗体药产业为例,我国整体能力与经验积累不足;当前总产能有限且布局分散的产业状况,不足以在成本控制领域达到竞争强势。目前我国抗体药实际总产能不足20万升,而韩国总产能为76万升。生物制品生产极其复杂,其扩产至少需要3~5年。生物制品现有生产格局下,一旦主要生产企业停止供应,是否还能够满足患者需求?此外,未来生物制药产业在“十四五”期间将成为政策鼓励和产业发展的重点领域,但我国生物制药产业的关键技术能力不足,关键材料主要依赖进口且生产成本高,大大限制了我国的生物制药产业技术创新和竞争力提升,因而整个产业的发展需要充分的时间进行培育。
第三,临床可替代性方面。相对于化学药品,生物制品具有特殊的安全风险,包括免疫毒性、特定靶点类型的不良反应(如抗肿瘤坏死因子抑制剂带来的恶性肿瘤的发生)等。为此,各国监管部门对其临床可替代性的管理均持审慎的态度。美国只有通过“可替代性”临床研究的生物类似药才能替代,但截至目前美国尚未有生物类似药通过“可替代性”临床研究,医生决策和个体给药仍是临床应用的常见情况。欧盟自2006年首个生物类似药批准上市后,收集了大量的真实世界数据,但9年后才有个别国家开始启动临床替代。但是由于已有研究的局限性,大部分欧盟成员国明确要求换药需由临床医生决定。同时,真实世界研究数据提示换药可能会增加患者的停药风险和医疗费用负担增高。以英夫利昔单抗为例,目前研究结果显示替代组的患者停药的比例(范围:24%~87%)明显高于对照组(范围:5%~38%)。
在我国,生物类似药与原研生物制品采用相同通用名命名。虽然药监部门给予不同企业生物类似药不同的商品名来进行区分,但临床医生仅使用通用名处方,未采用通用名结合商品名的方式,使得安全性数据以及真实世界数据收集困难。目前,我国的临床应用指导原则和治疗药物监测专家共识均强调医生的科学决策和个体给药,以确保患者用药安全。
加强药物警戒管理、完善上市后监管体系,促进真实世界研究,推动临床用药科学决策,是我国生物医药产业健康发展的基石。我国生物制药蓬勃发展,药品监管体系也在不断完善,但研发、生产、临床使用还需时间的积累,以满足“相似性”“稳定性”“可替代性”条件,确保疗效与安全,提高患者可及性。(RDPAC)
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐













