2020盘点:FDA批准的改良型新药
- 2021-01-08 14:31
- 作者:
- 来源:中国食品药品网
2020年,美国FDA批准的505b2产品数量并未比往年大幅减少,但质量大不如前,新概念、“黑科技”在2020年几乎销声匿迹。近2年FDA批准的505b2制剂中,缓控释制剂几乎不见踪影,2020年也仅批准了一个产品(恩格列净/利格列汀/二甲双胍缓释片)。为何高质量改良型新药越来越少?笔者认为,一是由于生物技术爆发,资本市场的主要目光转向了收益率更高的生物技术;二是化学小分子发展进入瓶颈期,适合改良且能够带来巨大临床优势的药物分子越来越难找到;三是“黑科技”、新概念产品生产成本高,市场推广困难,能够迅速做大市场的多为原研企业改良的产品;四是创新制剂是平台投资,“黑科技”新技术的备选产品较少,竞争较激烈,高水平重复率较高,收益下滑。
以下简要介绍7个美国FDA批准的改良型新药,大部分以改变给药途径为主。
1.阿扎胞苷片(ONUREG)
阿扎胞苷是celgene的几个关键产品之一,2004年获FDA批准上市,用于骨髓增生异常综合征(MDS)治疗,由于可引起胃肠道反应、白细胞减少和肝损害,此前一直局限于注射给药。口服版阿扎胞苷(ONUREG)于2020年9月1日获得FDA批准,用于经过高强度化疗后首次达到完全缓解或血细胞计数恢复的完全缓解,而不适合再接受高强度痊愈性化疗的急性髓细胞白血病治疗。ONUREG是首个获批的口服疗法,尽管口服生物利用度只有11%,鉴于其特殊的市场定位,有望成为年销售额超1亿美元的产品。
2.贝美前列素眼部植入剂(DURYSTA)
2020年3月4日,FDA批准了艾尔建的贝美前列素眼部注入剂,用于青光眼或高眼压症患者降眼压治疗。贝美前列素是青光眼领域最畅销的前列素Fα受体激动剂之一,最早在2001年获得FDA批准上市。为了解决专利悬崖问题,艾尔建之前已经改良过配方,将给药剂量下调,降低了不良反应发生率,但是每天给药,患者的顺应性依然不够理想。艾尔建的眼部植入技术平台已经非常成熟,之前获批上市的地塞米松眼部植入剂Ozurdex年销售额已达数亿美元,而本品上市后预计也将成为年销售额达数亿美元的明星眼科产品。
3.美洛昔康纳米晶注射剂(ANJESO)
2020年2月20日,FDA批准BAUDAX的美洛昔康注射剂ANJESO上市,单用或与非甾体抗炎药联合用于中重度疼痛管理。ANJESO是使用纳米晶技术制备的长效注射剂,未来市场潜力巨大。目前我国恒瑞医药已经申报。
4.芬氟拉明口服液(FINTEPLA)
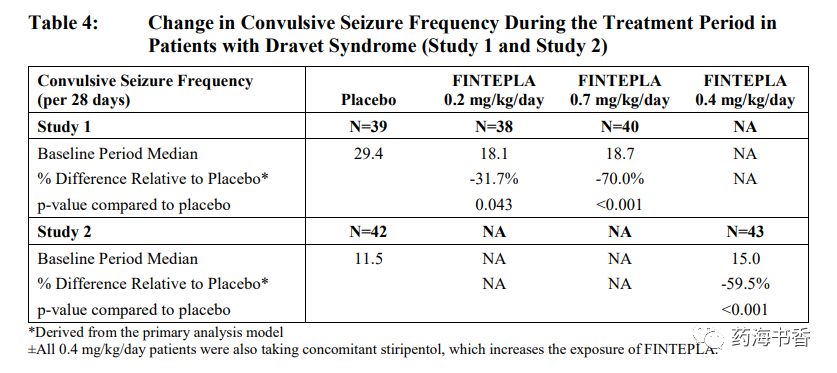
2020年6月25日,FDA批准了ZOGENIX公司的芬氟拉明口服液,用于Dravet综合征治疗。该产品此前已经获得FDA孤儿药资格和突破性疗法资格。除了Dravet综合征,本品开发的适应症还包括LG综合征,是销售额有望超过1亿美元的重量级产品。
5.布比卡因植入剂(XARACOLL)
2020年8月28日,FDA批准INNOCOLL制药的布比卡因植入剂上市,用于术后疼痛管理。本品是一种生物可降解的无菌植入剂,手术过程中在手术部位直接放入,布比卡因可从胶原蛋白中持续缓慢释放24小时,从而起到降低疼痛的效果。在此之前,FDA批准了布比卡因局部注射剂(多室脂质体),该产品与本品可以起到异曲同工的效果。目前布比卡因脂质体EXPAREL销售额已达数亿美元,而本品生产成本更低,使用更便捷,也有望成为一款年销售额突破1亿美元的重量级505b2产品。
6.富马酸单甲酯胶囊(BAFIERTAM)
2020年4月28日,FDA批准了BANNER公司的富马酸单甲酯肠溶胶囊,用于多发性硬化治疗。富马酸单甲酯是富马酸二甲酯的活性代谢物,富马酸二甲酯在口服后很快就被胃肠道酯酶水解成富马酸单甲酯,因此真正起效的是富马酸单甲酯。FDA批准该产品的原因也非常直接,一个与富马酸二甲酯的BE就通过了,虽然说是BE,其实本品的入血速度与富马酸二甲酯肠溶胶囊有很明显的时间差。FDA接受BE批准富马酸单甲酯上市,意味着本品的疗效与富马酸二甲酯相同,而富马酸二甲酸是年销售额超过30亿美元的产品,本品上市后的年销售额有望突破1亿美元。
7.奥曲肽肠溶胶囊(MYCAPSSA)
2020年6月26日,FDA批准CHIASMA公司的奥曲肽肠溶胶囊上市,这是首个奥曲肽口服制剂,获批用于不耐受奥曲肽或兰瑞肽注射治疗的肢端肥大症治疗。奥曲肽是一种生长抑素类似物,相比天然激素,该产品对生长激素、胰岛素等代谢性激素的抑制活性更强,是肢端肥大症的常用药物。然而奥曲肽半衰期较短,需要频繁注射,患者顺应性较差,故将其做成了缓释微球。虽然微球已经畅销多年,但技术过于复杂,目前还没有仿制产品上市。本品的上市,将为患者开启一项全新的疗法,也是多肽口服技术的巨大进步。
除了以上几个产品,值得一提的还有艾司奥美拉唑口崩肠溶片、地西泮鼻喷剂、枸橼酸/乳酸/酒石酸钾阴道凝胶、索利那新口服液、丝裂霉素泡沫剂、炔雌醇/左炔诺孕酮贴片和多替拉韦/拉米夫定/替诺福韦片等,其中多替拉韦/拉米夫定/替诺福韦是上海一家公司(SHANGHAI DESANA BIO-PHARMA)开发的产品,也是中国企业在美国获得的第二个505b2批文。笔者认为,HIV是非常值得布局的领域,虽然因吉里德、GSK等巨头的comb专利布局很全面而无法仿制,但可以根据治疗方案自主开发comb申报505b2,该产品或是中国企业走通的第一个案例。另外值得注意的是,欧洲批准了布比卡因/美洛昔康聚合物凝胶,加拿大批准了艾滋病超长效鸡尾酒(cabotegravir/利匹韦林纳米晶注射混悬剂),毕竟可做缓释注射剂、纳米晶注射混悬剂的产品不多,对于有平台的企业,可作为立项的备选。(药事纵横)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐












