研究揭示甲羟戊酸途径在肠道干细胞恶性转化及YAP高活性肠癌中的作用
- 2021-05-10 10:03
- 作者:
- 来源:中国科学院官网
近期,Molecular Cell在线发表了中国科学院上海营养与健康研究所研究员秦骏、研究员肖意传课题组与复旦大学附属肿瘤医院教授彭俊杰团队合作的研究论文——The ZMYND8-regulated mevalonate pathway endows YAP-high intestinal cancer with metabolic vulnerability。该研究揭示了YAPhigh的肠癌细胞高度依赖组蛋白修饰阅读因子ZMYND8介导的甲羟戊酸(MVA)途径,揭示他汀类药物对YAPhigh肠癌的治疗可能更有效。
来源于隐窝的Lgr5+肠道干细胞(ISC)对维持肠道稳态具有重要意义,而ISC的功能异常也会导致结直肠癌(CRC)的发生。异常的胆固醇和脂质合成被认为是癌细胞代谢重编程的重要指标之一。胆固醇是细胞膜的重要组成成分,同时胆固醇相关的代谢产物也能够作为信号分子发挥调节作用。研究表明,癌细胞通过激活甲羟戊酸(MVA)通路,大量合成胆固醇从而维持自身的快速增殖和干细胞特性。
该研究中,研究人员通过基于肠道类器官的CRISP/Cas9文库筛选,发现组蛋白修饰阅读因子ZMYND8对维持Lgr5+ ISC的功能具有重要意义。ZMYND8的缺失显著抑制肠道的自我更新及肠癌的发生。机制研究表明,ZMYND8的敲除会导致MVA通路基因的显著下调,进而胆固醇合成能力减弱。ZMYND8优先结合增强子,通过与SREBP2的相互作用形成增强子-启动子环,并通过招募Mediator复合物,在转录水平激活MVA通路,促进胆固醇的合成。研究发现,YAP通过调控ZMYND8的表达进而激活MVA通路从而促进Lgr5+ ISC的恶性转化以及肠癌发生发展。但正由于这种依赖性,YAPhigh肿瘤细胞也同时表现为对他汀类药物治疗的高敏感性。
综上所述,该研究揭示了肠道隐窝干细胞更加依赖于自我合成胆固醇从而维持其快速增殖及分化。此外,研究还提示,胆固醇还可作为信号分子激活mTOR信号通路促进干细胞的增殖及分化。而他汀类药物对治疗YAPhigh的CRC可能具有更好的疗效。
营养与健康所博士生潘强、仲珊珊以及王瀚玲为论文的共同第一作者,秦骏、肖意传、彭俊杰为论文的共同通讯作者。研究工作得到营养与健康所研究员尹慧勇、中科院上海药物研究所研究员谭敏佳、中科院分子细胞科学卓越创新中心研究员李劲松、陆军军医大学附属大坪医院教授江军、四川大学附属华西第二医院教授李沁桐的帮助,获得科学技术部、国家自然科学基金委及中科院等项目的资助,得到营养与健康所公共技术平台和动物平台的支持。
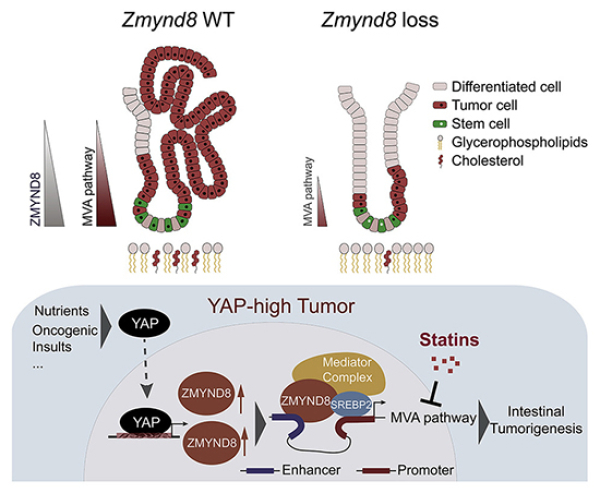
YAP-ZMYND8-MVA信号轴在肠道干细胞稳态及恶性转化中的作用机制
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐