同质化严重的PD-1,海外市场能否找到出路
- 2021-06-01 16:21
- 作者:
- 来源:药智网
日前,信达生物与礼来制药共同宣布,双方共同合作研发的PD-1抑制剂信迪利单抗新药上市申请(BLA)在美国进入正式审评阶段,成为首个我国自主研发的创新生物药完整上市申请首次被美国FDA受理并进入正式审评阶段,同时也是第一个完整上市申请被欧美国家监管机构受理并进入正式审评阶段的我国自主研发的创新生物药。
全球PD-1/PD-L1临床在研登记3500+
研发扎堆,国产PD-1同质化严重
PD-1作为开启划时代的抗肿瘤药物,通过调动人体自身的免疫功能,实现抗肿瘤作用,不仅疗效好安全性高,且拥有广泛的适应症,近年在抗肿瘤创新药领域炙手可热。
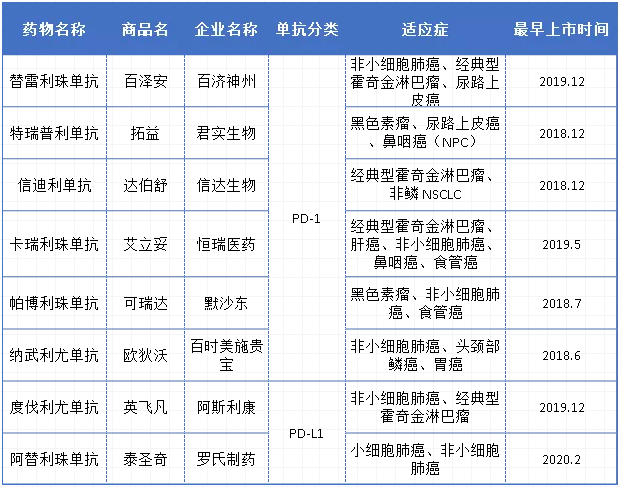
据药智数据显示,截至目前,国内已有8款PD-1/PD-L1单抗上市,包括4款国产PD-1、2款进口PD-1和2款进口PD-L1。基石药业的舒格利单抗注射液和四川思路康瑞药业的恩沃利单抗注射液已相继申报上市,国内首款PD-L1或将在两家企业中诞生;此外,还有无锡药明生物的赛帕利单抗注射液、中山康方生物的派安普利单抗注射液、玉溪嘉和生物的杰诺单抗注射液3款国产PD-1申报上市获受理。
国内已获批的PD-1/PD-L1详情表
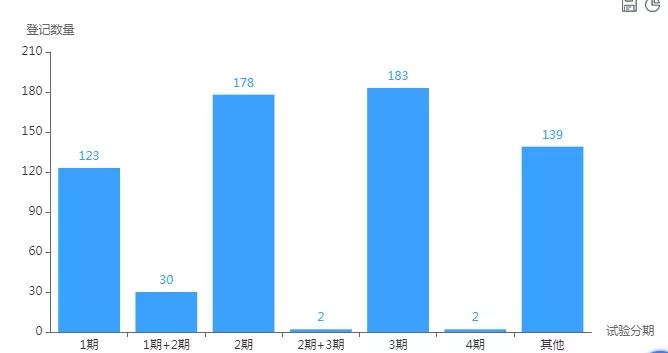
另据药智全球临床试验数据库不完全统计,全球有3250项关于PD-1/PD-L1抑制剂临床试验登记,其中有817条登记号显示为3期临床阶段;目前国内关于PD-1/PD-L1临床试验登记数量累计有657条,涉及企业150余家,其中已有183条处于3期临床阶段,产品差异化不明显,靶点大多相同,重复过度研究。
国内PD-1/PD-L1抑制剂临床研究阶段概况
值得提及的是,目前国产PD-1已全部通过医保谈判纳入国家医保目录,药品价格降幅为62.2%~85.2%,至此PD-1药品价格进入万元时代。大幅降价后,据业界预测,国内PD-1市场已从此前预测的“千亿元”,缩水至“300亿元”,且随着越来越多国产PD-(L)1的出现,竞争将越来越激烈。
我国PD-1/PD-L1未来路在何方
PD-1新药研发已是过度重复,同质化严重;尤其是国产PD-1在前有医保降价、后有新药上市追赶的困境下,竞争激烈,迫使国产PD-1企业将目光瞄向海外市场。但是,国外还有“O药”(Opdivo)与“K药”(Keytruda)环伺,2020年“K药”位居全球畅销药第二名,销售额达143.8亿美元,“O药”位列第八名,全球销售额达79.2亿美元。那么,国产PD-1出海能否找到增量?又该如何突破困境?
前FDA专家/资深流行病学家、统计学家孙立英表示,国产PD-1出海能否获得增量,取决于企业的海外布局以及能力,如信达药业,其拥有雄厚资本,海外扩张迅速,且与礼来达成战略合作,极有可能找到增量。在集采的压力下,一场同质化的药业/药品竞争与兼并已迫在眉睫,预计相当一部分上市的PD-1和PD-L1会退出国内市场,而有竞争能力的企业将去国外布局。
那么,中国PD-1/PD-L1未来路在何方?孙立英认为,第一是开发新适应症;第二是开发联合用药;第三是推动国家用药政策,如国家要求检测肿瘤PD-1表达,如表达超过5%,则要求使用PD-1或PD-L1;第四是实现国际化,国产PD-1因积极参与国际竞争,不仅拓展欧、美、日等国海外注册申报,同时在一带一路沿线非洲及拉丁美洲等也拓展布局,积极申报注册上市,获得交易海外市场权益。
战略专家杜臣则认为,全球药品市场有不同的需求,发达市场、新兴市场和低收入国家市场一定存在增量。但关键在于产品定位与具体市场需求的结合,与“O药”和“K药”以及国内一起出海产品形成差异化竞争。但是现在国产PD-1同质化严重,差异化不明显,企业想要在出海中抢得先机,除准确定位和差异化以外,以下几点也很重要:一是与出海地伙伴合作耕耘当地市场;二是在剂量、说明书、不良反应等方面要符合当地人种实际;三是在当地做好临床补充试验,充实当地人种临床数据。
“生物仿制药竞争的不是存量,而是增量,仿制药与原研药、仿制药与仿制药之间都是如此。国产PD-1出海能否实现增量,关键在于企业自身的销售能力,此外还需要了解美国市场,尤其是了解美国销售,故而应该寻求合作伙伴共同拓展商业权益,好药往往不是‘做’来的,而是‘卖’出来的。”医药独立评论人孟八一认为。
国内外双报、寻求海外合作,拓展国际化商业权益几乎是专家们一致的共识。
事实上,截至目前,国产上市的4款PD-1单抗均有或在谋划海外授权开发,合作开发拓展商业权益。百济神州与诺华就替雷利珠单抗在多个国家的开发、生产与商业化达成合作与授权协议;信达生物与礼来达成战略合作,礼来获得信迪利单抗在中国以外地区的独家许可;恒瑞医药与韩国Crystal Genomics(CG)合作,CG获得恒瑞医药PD-1在韩国的独家临床开发、注册和市场销售的权利;君实生物和阿斯利康双方也宣布继续探讨海外包括新兴市场在内的商业合作可能性;今年3月,君实生物特瑞普利单抗已向美国FDA提交上市申请,为首个向FDA提交BLA的国产抗PD-1单抗,现被信达生物超车。此外,2021年2月,君实生物与美国Coherus公司就拓益在美国和加拿大的开发和商业化达成合作。
PD-1出口海外,加入国际化竞争已然成为趋势,“出海”能否找到增量,能否打破囚徒困境,只能各凭本事。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐













