GVP逐条谈 | 86.这些药品的PSUR要注意!
- 2021-09-23 14:01
- 作者:邵灿灿
- 来源:中国食品药品网
【条文】
《药物警戒质量管理规范》第五章 风险识别与评估
第四节 定期安全性更新报告
第八十六条 除药品监督管理部门另有要求外,以下药品或按药品管理的产品不需要提交定期安全性更新报告:原料药、体外诊断试剂、中药材、中药饮片。
【理解】
·关键点1:需要提交PSUR的药品有哪些?
第八十六条明确了原料药、体外诊断试剂、中药材、中药饮片不需要提交定期安全性更新报告。回顾一下GVP第八十条:创新药和改良型新药应当自取得批准证明文件之日起每满1年提交一次定期安全性更新报告,直至首次再注册,之后每5年报告一次。其他类别的药品,一般应当自取得批准证明文件之日起每5年报告一次。药品监督管理部门或药品不良反应监测机构另有要求的,应当按照要求提交。
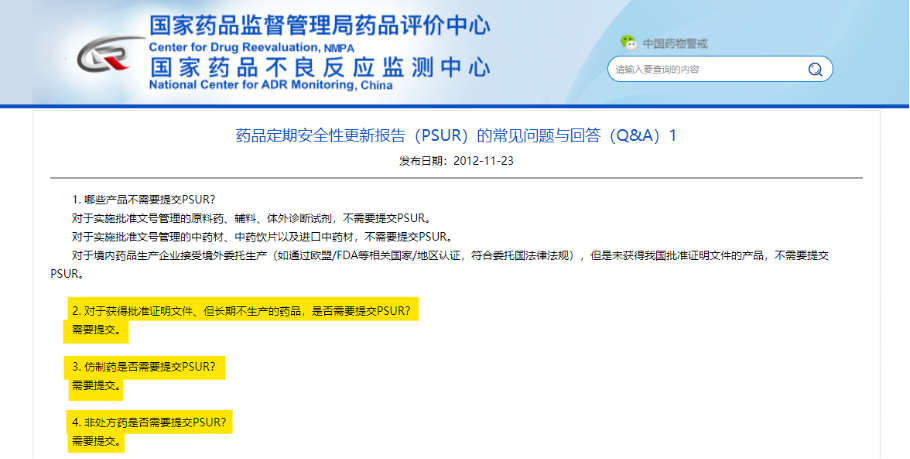
那么还有哪些药需要提交PSUR呢?根据药品定期安全性更新报告(PSUR)的常见问题与回答(Q&A)1的说明,需要提交PSUR的还包括:仿制药、非处方药、获得批准证明文件但长期不生产的药品。此外,按照PSUR报告期应当连续完整、不应当有遗漏或者重复的原则,对于之前并未提交定期汇总报告或者PSUR的国产药品,药品生产企业应当以首次获得国家药监局批准证明文件的时间作为首个PSUR报告期的起始时间。
·关键点2:DSUR & PSUR
研发期间安全性更新报告(DSUR)主要关注在研的药物和生物制品(无论是否获批上市)干预性临床试验的数据和发现。PSUR主要针对已获批上市药品的安全性进行定期报告。
如果一个药品在获得上市许可后仍有临床试验正在进行(即临床试验IV期),那么它的DSUR中可能包含已上市药品在临床试验中获得的安全性发现,这同时属于上市后安全性信息,应在PSUR中进行报告。该药品上市后信息(PSUR中的内容)可能会与临床研发相关,因此,也应在DSUR中进行报告。
如果药品在任何一个国家或地区获得上市批准后继续进行研发,那么应当依据国家或地区的法律法规递交DSUR和PSUR。如果申办者需要,可以在PSUR国际诞生日(IBD)的基础上准备DSUR,以便二者保持同步。两份报告数据锁定点同步后,下一次DSUR递交周期不应超过一年。
例如:某药于2018年1月15日获得药品注册批件,于2021年5月31日获得另一适应症的临床试验批件,那么该药的DSUR的数据起始点可以使用IBD 2018年1月15日,首次DSUR的报告期为2018年1月15日至2022年1月14日。下一份DSUR的报告期为2022年1月15日至2023年1月14日,以此类推后续DSUR报告期。
·关键点3:PSUR中涉及临床研究的章节
参考《药品定期安全性更新报告撰写规范》第七章 安全性相关的研究信息:
与药品安全相关的研究信息,包括非临床研究信息、临床研究信息和流行病学研究信息。根据研究完成或发表与否,按已完成的研究、计划或正在进行的研究和已发表的研究进行介绍。
1. 已完成的研究
由药品生产企业发起或资助的安全性相关研究,对其中已完成的,药品生产企业应清楚、简明扼要地介绍研究方案、研究结果和结论,并提交研究报告。
2. 计划或正在进行的研究
由药品生产企业发起或资助的安全性相关研究,对其中计划实施或正在实施的,药品生产企业应清楚、简明扼要地介绍研究目的、研究开始时间、预期完成时间、受试者数量以及研究方案摘要。
如果在报告期内已经完成了研究的中期分析,并且中期分析包含药品安全有关的信息,药品生产企业应提交中期分析结果。
3. 已发表的研究
药品生产企业应总结国内外医学文献(包括会议摘要)中与药品安全有关的信息,包括重要的阳性结果或阴性结果,并附参考文献。
【实践影响】
申办者/上市许可持有人需要根据药品的临床研发/上市的阶段来撰写DSUR和(或)PSUR。
【延伸阅读】
《药品定期安全性更新报告撰写规范》
《研发期间安全性更新报告 E2F ICH三方协调指导原则》(浙江太美医疗科技股份有限公司高级医学专员 邵灿灿)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐
-

行政处罚裁量 | 不确定法律概念有了确定的范围——浅析《药品监督管理行政处罚裁量适用规则》
《裁量规则》对“初次违法”“危害后果轻微”“及时改正”“充分证据”“情节严重”等不确定法律概念进行了不同程度的细化、明确、缩窄范围,并对适用这些不确定法律概念需要注意的事项给予规范... 2024-04-23 14:07 -