中国罕见病药物支持政策梳理(上):研发和注册
- 2021-11-24 16:01
- 作者:艾昆纬
- 来源:中国食品药品网
近年来,罕见病患者的用药问题,日益受到国家层面的高度重视。国家出台了一系列政策,如加速罕见病药品审评审批、公布国家罕见病名录、在医保目录调整中优先考虑罕见病等,以提高罕见病药品的可及性。
回溯历史,全国范围内对于罕见病的相关支持政策从无到有,罕见病药物保障政策利好涉及药物从研发注册到上市使用的各个阶段。
本系列将从罕见病药物生命周期的角度梳理近年来中国罕见病药物保障方面的相关政策,作为系列文章的上篇,本文将主要聚焦罕见病药物研发和注册相关政策。
罕见病定义的修订及完善
在中国,罕见病尚没有明确的法律释义。专家表示随着医学进步和社会对罕见病认知的不断提高,罕见病定义要符合不断变化和发展的历史,应当对罕见病定义适时进行调整,使其符合社会发展的特点和民众的需求。
罕见病定义的修订和完善,有利于中国罕见病诊疗与保障事业的规范化、制度化、法治化发展。罕见病定义将可能成为制定中国罕见病目录的主要标准之一、制定中国孤儿药定义的参考依据之一、调整国家基本药品目录的参考依据之一。
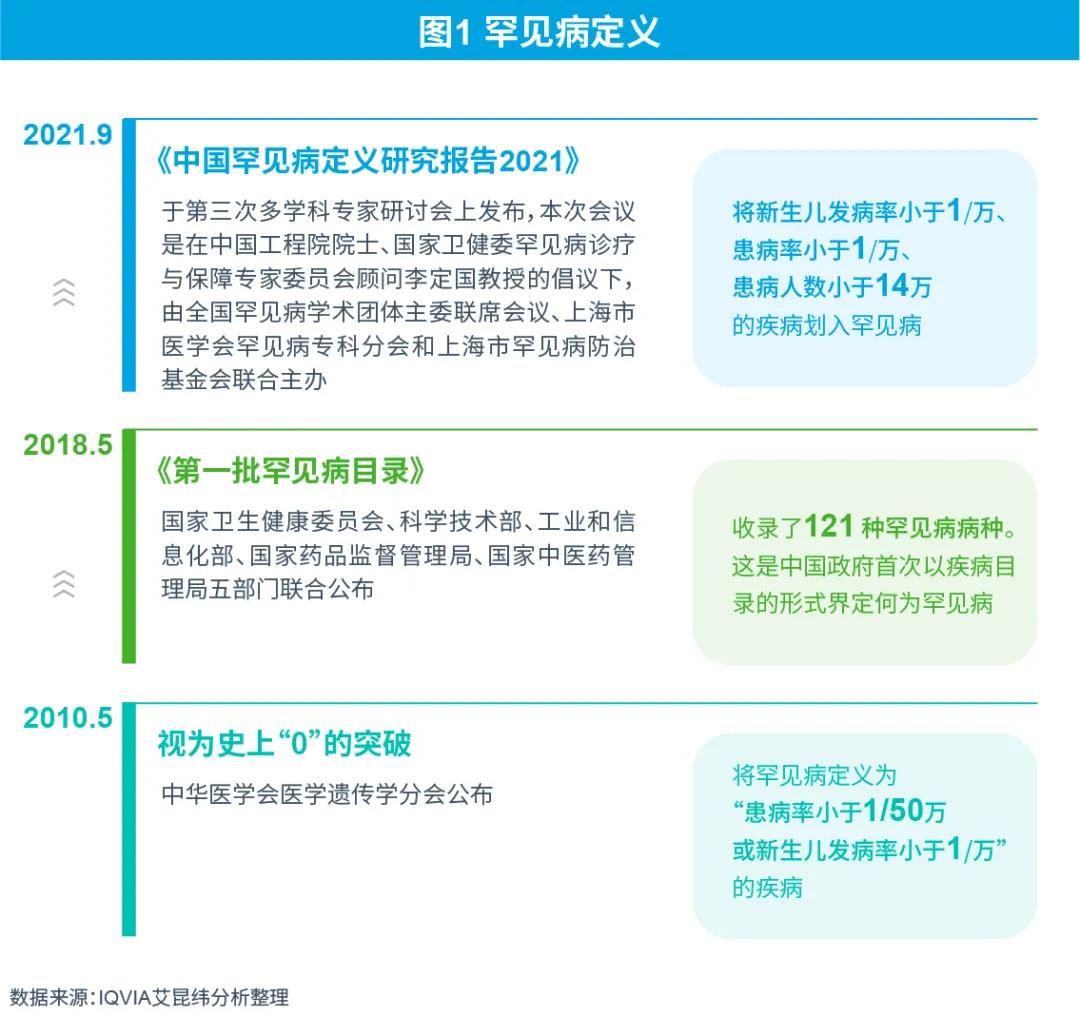
中国罕见病目录公布及更新
2018年5月《第一批罕见病目录》公布是中国罕见病管理的一个里程碑式事件,因为是以目录的形式确定了罕见病的定义,有了目录以后,医疗药品审批,包括保障都有了重要的参考依据。
2021年4月27日,全国罕见病诊疗协作网办公室副主任、中国罕见病联盟执行理事长李林康介绍了第二批罕见病目录的制定进展。李林康指出,2021年要适时地开展第二批目录的遴选工作,到目前为止,国家卫健委罕见病诊疗与保障专家委员会办公室已经收到了将近200份申请,将进行材料审评、专家论证和公示等既定的遴选程序。

罕见病药物研发相关政策
国家鼓励创新,减少罕见病等创新药物上市的滞后性,从而减少新药在美国和中国之间的批准时间差。

案例:2017年,全球首个治疗庞贝氏病的罕见病药物“美而赞”(注射用阿糖苷酶α),通过原国家食品药品监督管理总局免三期临床试验的政策,获准进入中国市场。
罕见病药物注册相关政策
政策的利好加速了审评审批速度,起到了罕见病药品上市“加速器”的作用。

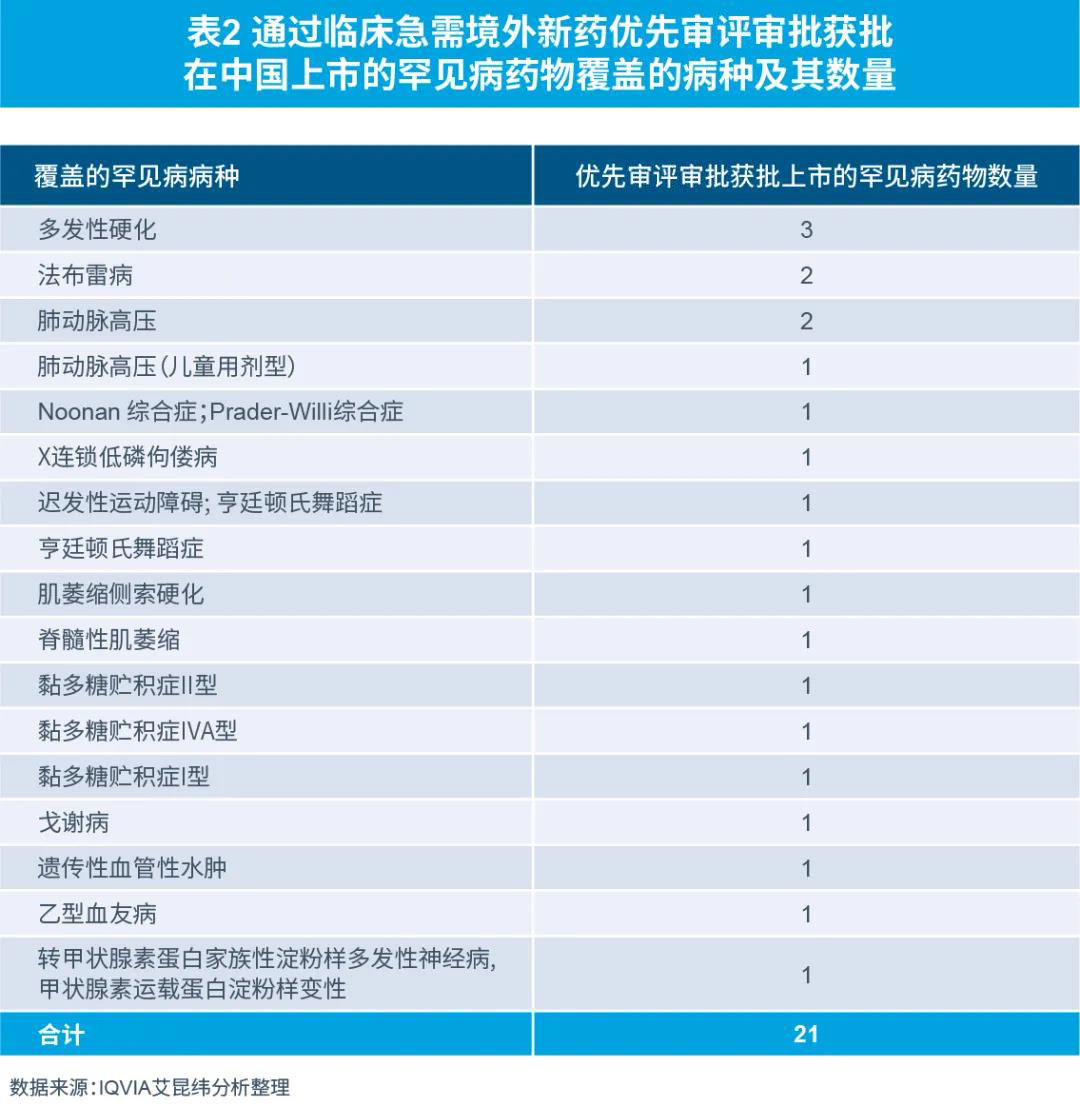
在罕见病药物注册审批方面,国家药监局从2018年11月开始到2020年10月,三次共推出81种境外已上市临床急需新药名单,列入名单的品种可按《临床急需境外新药审评审批工作程序》提交相关资料,直接提出上市申请,CDE建立专门通道加快审评。尚未申报的品种,可提出与国家药监局药审中心(CDE)进行沟通交流,尽快提出上市申请。

截至2021年10月21日,21种罕见病药品通过优先审评审批获批上市,其中:
2021年获批上市7种
2020年和2019年各获批上市6种
2018年获批上市1种
还有1种上市时间未知
通过临床急需境外新药优先审评审批获得中国上市的21种罕见病药物覆盖罕见病病种包括黏多糖贮积症、亨廷顿舞蹈症、多发性硬化、脊髓性肌萎缩症等15种罕见病,帮助众多罕见病患者解决了治疗药物非常有限,甚至无药可用的困境。
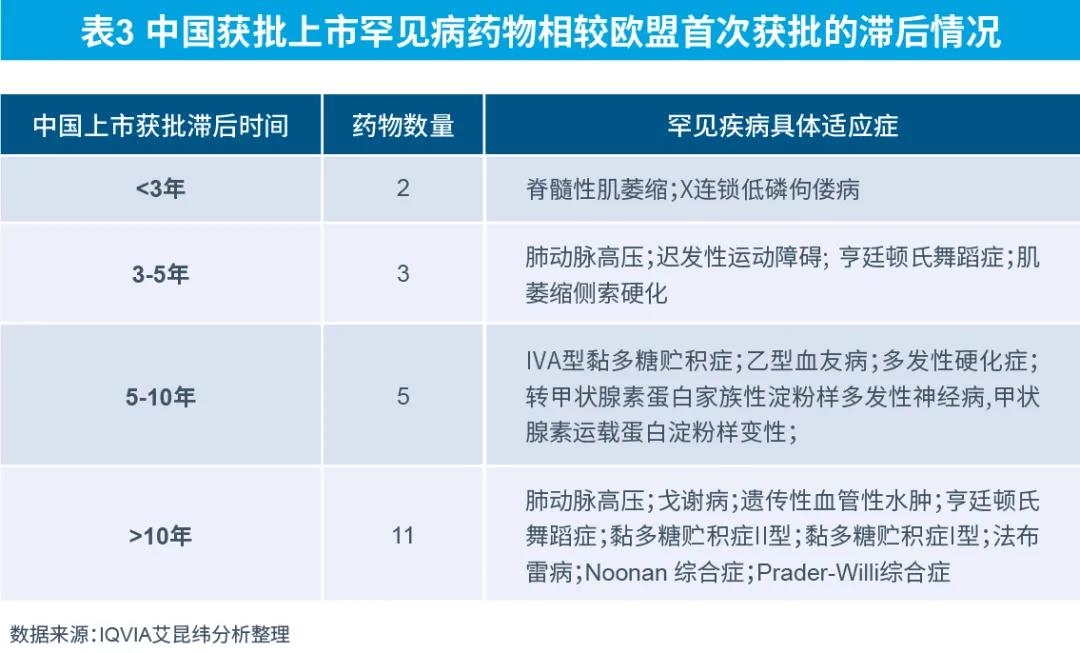
目前我国获批上市罕见病药物与欧盟首次获批时间相比,即使是通过优先审评审批,上市时间仍滞后平均约9.5年。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐












