1月份中美欧批准上市新药盘点
- 2022-02-24 09:50
- 作者:陈倩
- 来源:中国医药报
1月份,中美欧共批准14款新药上市。
我国批准4款新药上市 2款为自主研发
1月份,我国共批准4款新药上市,其中淫羊藿素软胶囊、奥木替韦单抗注射液为自主研发(详见表1)。
来特莫韦片可抑制用于CMV病毒DNA加工和包装的末端酶复合物(pUL51,pUL56,pUL89),于2017年在美国首次获批上市。CMV是一类常见的孢疹病毒,在人类血清中的阳性率为30%~97%。移植术患者处于免疫抑制状态,术后继发CMV感染的发生率远远高于正常人群。
淫羊藿素(阿可拉定)软胶囊被批准用于晚期肝细胞癌患者,患者外周血复合标志物满足以下检测指标的至少两项:AFP≥400 ng/ml;TNF-α<2.5 pg/ml;IFN-γ≥7.0 pg/ml。本次获批基于一项纳入280例未经一线系统性治疗的晚期肝细胞癌患者的研究,患者随机分配至阿可拉定治疗组(n=140)或华蟾素对照组(n=140)。富集人群中,90%以上为HBV相关肝癌患者,近90%人群高表达甲胎蛋白(AFP≥400ng/ml),且大多数患者伴有肿瘤肝外转移或血管浸润,肝功能较差,血小板计数偏低。该研究结果显示,在富集人群中,阿可拉定组中位OS(总体生存率)显著优于对照组。
奥木替韦单抗注射液由华北制药自主创新研发,被列为国家“重大新药创制”科技重大专项品种。其作用机制及适应症是,与人用狂犬病疫苗联用,以补充人用狂犬病疫苗主动免疫过程中的抗体空白,可直接中和体内狂犬病毒,起到被动免疫作用,用于被狂犬或其他狂犬病毒易感动物咬伤、抓伤患者的被动免疫。2018年4月,该药完成了Ⅱ期临床试验,结果显示与疫苗联用起效更快。
罗特西普(Luspatercept)是一种全球首创的红细胞成熟剂,用于调节晚期红细胞成熟。作为全球首个重组融合蛋白类药物,罗特西普可通过促进晚期红细胞的成熟,提高血红蛋白水平。注射用罗特西普用于治疗需要定期输注红细胞且红细胞输注≤15单位/24周的β-地中海贫血成人患者。这是中国首个且唯一一个获批的红细胞成熟剂,也是十余年来中国首个获批的用于治疗β-地中海贫血的创新药物。β-地中海贫血是一类由于β珠蛋白肽链合成减少或缺乏而引起的以贫血为特征的遗传性血液病。重度β-地中海贫血是一种呈慢性进行性溶血性贫血的罕见疾病。造血干细胞移植是目前唯一可根治该病的治疗手段,但该手段存在配型概率低、年龄限制等问题。此前,无法接受造血干细胞移植的成人患者,仅能依靠终身输血与补铁维持生命。
美国批准4款新药上市 3款获加速批准
1月份,美国批准上市4款新药,其中3款获得加速批准。除Abrocitinib外,其余3款均为全球首次获批(详见表2)。
Daridorexant是一款双重食欲素受体(Orexin Receptor)拮抗剂。与一般镇静大脑的疗法不同,它通过阻断促觉醒神经肽食欲素的结合,抑制过度活跃的不眠状态。
此次批准基于一项Ⅲ期临床研究获得的积极结果。该项研究分为两项关键性试验,共入组1854例失眠症成人患者,患者随机接受不同剂量的Daridorexant或安慰剂每日给药1次的治疗。两项试验的主要疗效终点为从基线到第1个月和第3个月患者进入持续性睡眠所需时间(LPS)和入睡后觉醒(WASO)的变化。LPS是入睡的指标,WASO是睡眠维持的指标。试验次要终点是患者报告的总睡眠时间(sTST)。该Ⅲ期临床试验项目结果表明,与安慰剂组相比,剂量为50mg的Daridorexant显著改善患者入睡和睡眠维持的客观指标,以及患者报告的总睡眠时间。50mg剂量水平的Daridorexant还显著减少了患者的日间嗜睡情况。安全性上,最常见的不良反应为头痛、嗜睡或疲乏。
Abrocitinib是一款口服小分子药物,能选择性抑制JAK1,从而调控参与特异性皮炎病理的多种细胞因子,如白介素-4(IL-4)、I L-13、I L-22和胸腺基质淋巴细胞生成素(TSLP)。此前,该药已在欧盟、英国、日本、韩国等国家和地区获得上市许可。此次美国食品药品管理局(FDA)的批准是基于5项大规模临床试验项目的结果。这些试验共招募超过1600名患者。其中,JADE MONO-1和JADE MONO-2试验是一对随机、双盲、安慰剂对照研究,在12岁及以上中度至重度特应性皮炎患者中开展,旨在评估Abrocitinib单药治疗的有效性和安全性。
Tebentafusp-tebn是美国FDA批准的首款用于治疗不可切除或转移性葡萄膜黑色素瘤的疗法、首款T细胞受体(TCR)疗法,也是首款用于治疗实体肿瘤的双特异性T细胞接头。作为一款创新的双特异性蛋白,Tebentafusp由两部分融合而成:一端是具有高亲和力的可溶性T细胞受体,另一端是抗CD3的免疫效应结构域。该疗法能特异性地靶向一种在黑色素细胞和黑色素瘤中表达的抗原——gp100。此前,这款“first-in-class”疗法已获得美国FDA的突破性疗法认定、快速通道资格、“孤儿药”资格,以及优先审评资格。此次获批是基于一项Ⅲ期临床试验的结果。该试验招募了之前尚未经过治疗的葡萄膜黑色素瘤患者,他们均为HLA-A*02∶01阳性。患者以2∶1的比例被随机分为两组,前者接受Tebent af usp的治疗,后者接受活性对照药物的治疗。
Faricimab是一款双特异性抗体,同时靶向作用于血管内皮生长因子A(VEGF-A)和血管生成素2(Ang-2)这两条不同的信号通路。从生物学机制上看,VEGF-A和Ang-2信号会使血管不稳定,诱导形成新生血管和促进炎症。Faricimab在阻断VEGF/VEGFR信号有效控制新生血管形成的同时,也能抑制Ang-2信号以改善血管稳定性和减轻视网膜炎症。该药是美国FDA批准的第一款用于眼科疾病治疗的双抗药物。此次获批基于两项代号为TENAYA和LUCERNE的Ⅲ期临床试验研究:分别在671例和658例湿性年龄相关性黄斑变性(wAMD)患者中,评估Faricimab和阿柏西普的有效性和安全性差异。
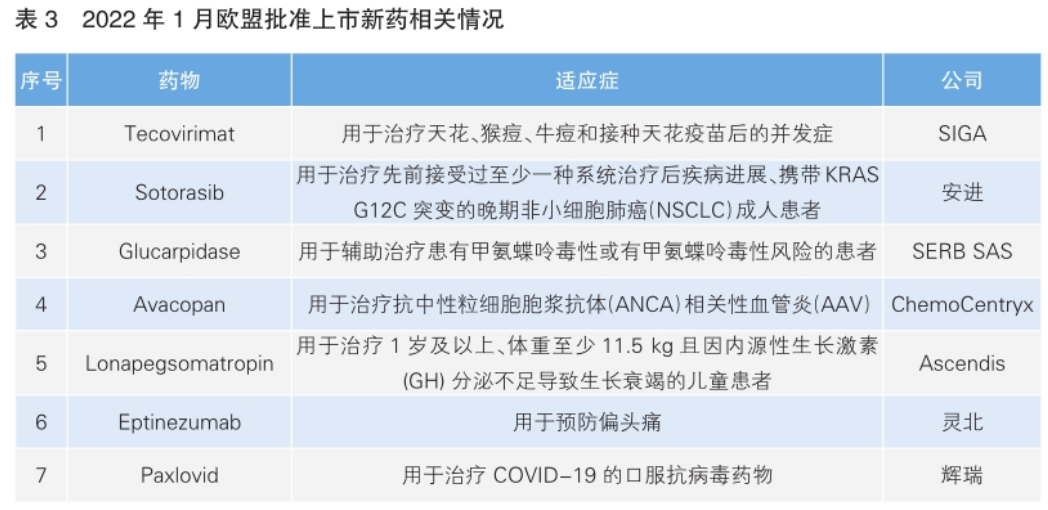
欧盟批准7款新药上市 均非全球首次获批
1月份,欧盟共批准7款新药上市。根据Phar madigger数据库信息,这7款新药均不是全球首次获批(详见表3)。
其中,Eptinezumab是一种靶向于降钙素基因相关肽(CGRP)的人源化单克隆抗体,对CGRPα和β形式具有高特异性和低皮摩尔亲和性,通过静脉注射给药。该药的批准主要基于两项Ⅲ期临床试验,即针对发作性偏头痛的PROMISE-1试验和针对慢性偏头痛的PROMISE-2试验。该药最常见的不良反应是鼻咽炎和超敏反应。
Glucarpidase被批准用于辅助治疗患有甲氨蝶呤毒性或有甲氨蝶呤毒性风险的患者。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐