每周医药看点(5.10—5.16)
- 2023-05-18 09:19
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 14部门联合印发《2023年纠正医药购销领域和医疗服务中不正之风工作要点》;国家药监局发布第六十八批仿制药参比制剂目录……5月10日—5月16日,医药行业的这些动态值得关注。
行业政策动态
1.国家卫生健康委等14个部门日前联合印发《2023年纠正医药购销领域和医疗服务中不正之风工作要点》,要求健全完善行风治理体系,重点整治医药领域突出腐败问题。这是按照国务院组成部门和相关职能调整情况,纠正医药购销领域和医疗服务中不正之风部际联席工作机制成员单位进行调整后,首次对纠风工作进行部署。通知要求,健全完善新时代纠风工作体系,优化纠风机制成员单位,保证纠风管理体系与部门职能调整的实际情况相衔接。重视纪检监察部门在纠风工作中的协调组织与指导作用。畅通举报投诉渠道,落实规纪法衔接的部门主体责任,切实推进全行业“受贿行贿一起查”。
2.国家药监局发布仿制药参比制剂目录(第六十八批),涉及聚乙二醇滴眼液等药品。
3.国家药监局局长焦红与德国药品和医疗器械管理局局长卡尔·布罗伊希在京签署了《中华人民共和国国家药品监督管理局与德意志联邦共和国药品和医疗器械管理局联合意向声明》。《联合意向声明》明确了双方未来的合作领域和方向,进一步加强双方在药品医疗器械法律法规、安全信息、审评、检测、人员交流、技术合作领域的合作。
4.国家药监局药品审评中心发布关于公开征求ICH《Q13:原料药和制剂的连续制造》实施建议和中文版意见的通知。该指导原则适用于化学实体和治疗性蛋白的原料药和制剂的连续制造,适用于新产品(如新药、仿制药、生物类似物)的连续制造以及现有产品由生产工艺向连续制造工艺的转化。指导原则中描述的原则也适用于其他生物制品/生物技术产品。
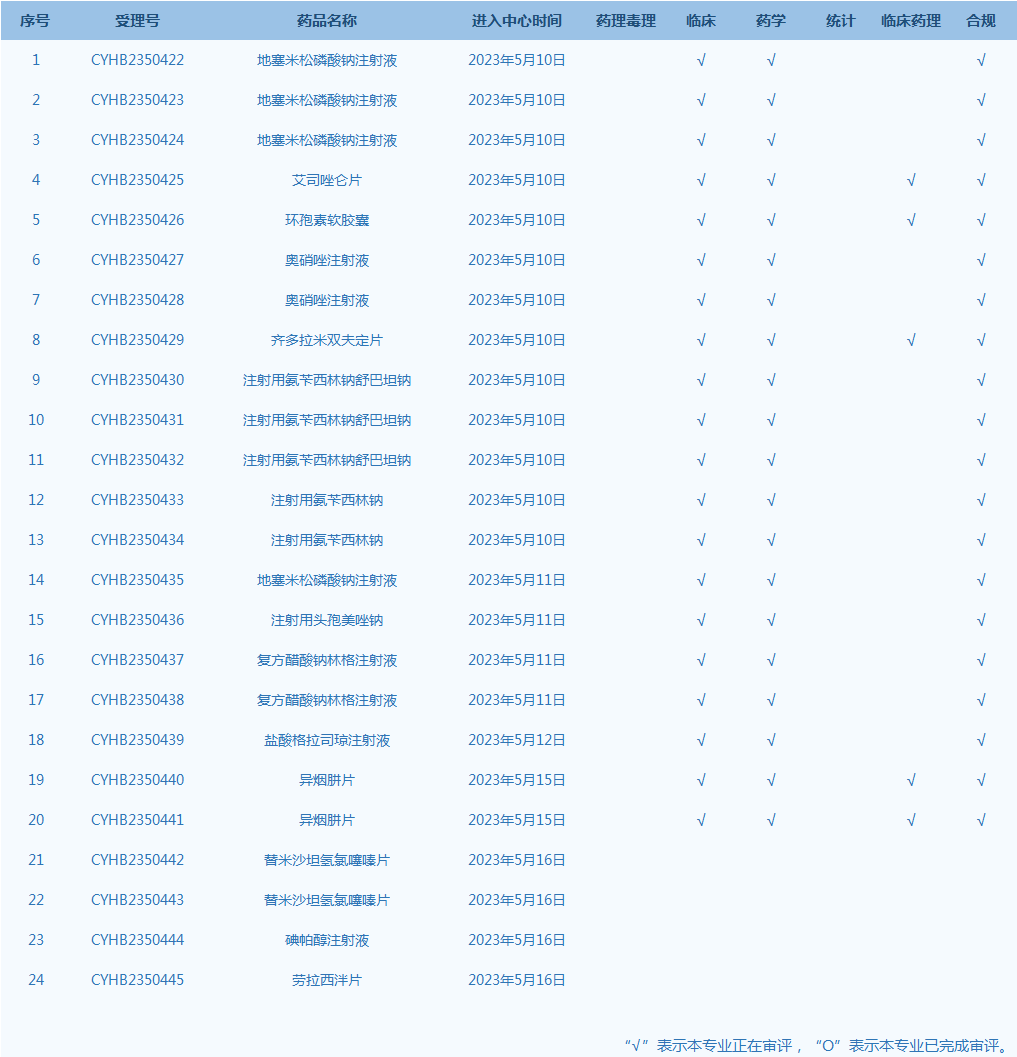
5.国家药监局药品审评中心网站公示24个仿制药一致性评价任务,涉及地塞米松磷酸钠注射液等药品。(截至5月16日)
产品研发上市信息
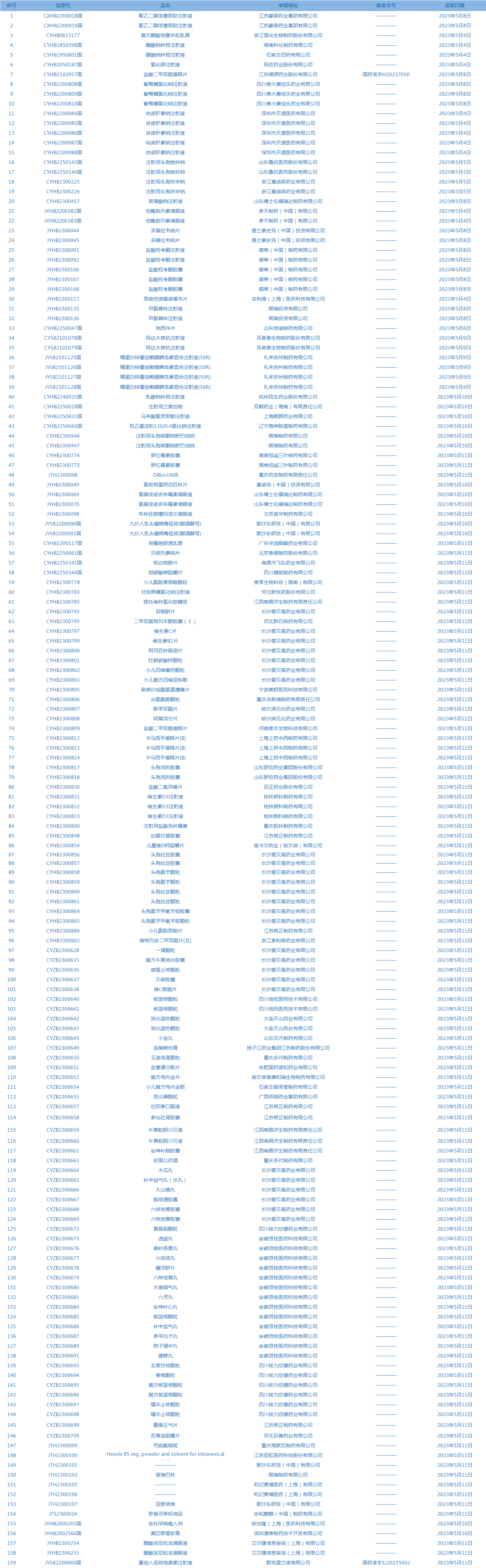
1.国家药监局发布4期药品批准证明文件送达信息,共包括159个受理号,涉及江苏豪森药业集团有限公司等企业。(截至5月16日)
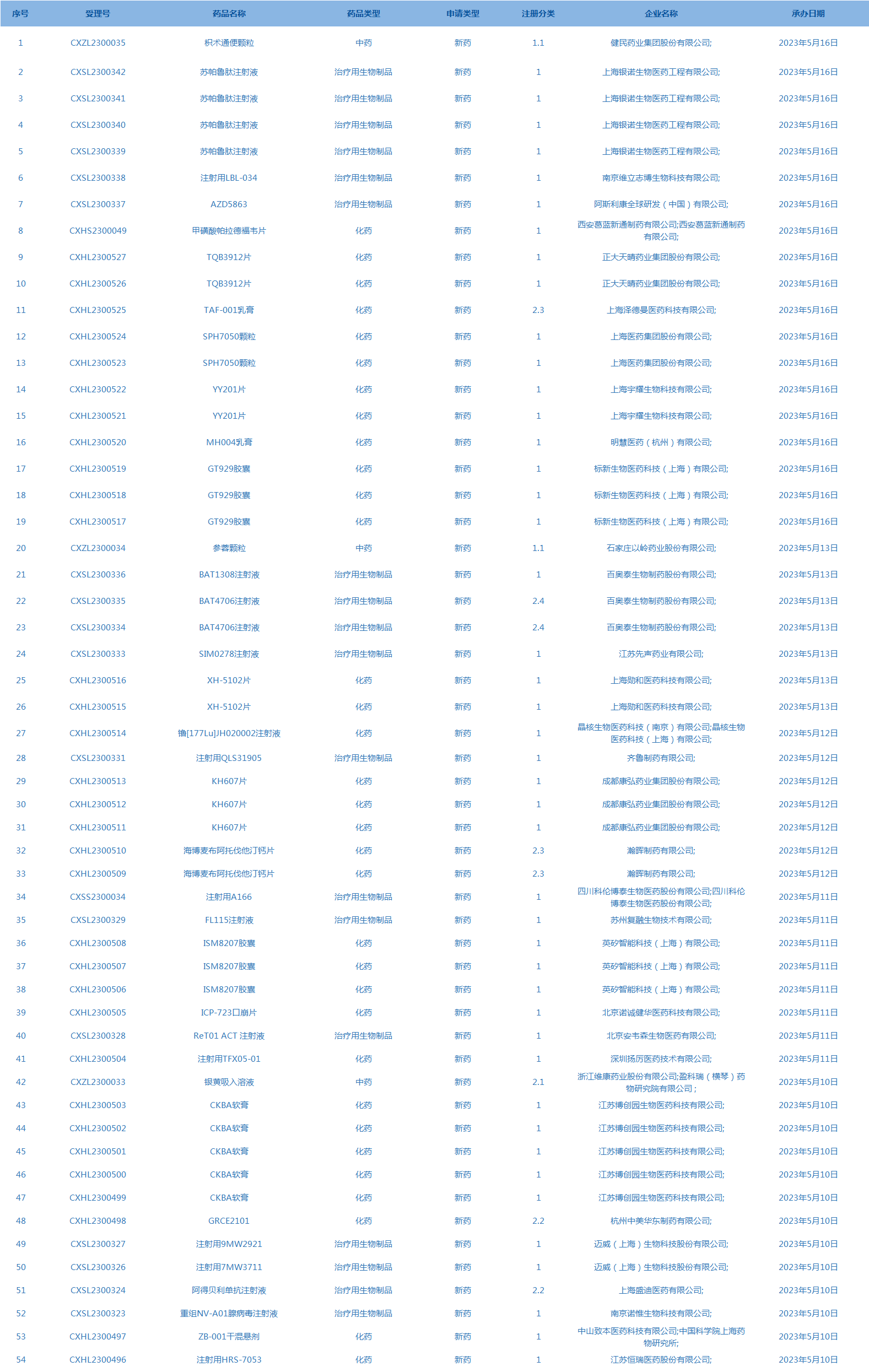
2.国家药监局药品审评中心承办受理54个新药上市申请,包括苏帕鲁肽注射液等药品。(截至5月16日)
3.翰宇药业发布公告称,公司注射剂生产线通过了欧盟克罗地亚药品及医疗器械管理局的药品生产质量管理规范(GMP)复认证。
4.宣泰医药发布公告称,公司向美国食品药品管理局(FDA)申报的美沙拉秦肠溶片的新药简略申请(ANDA)已获得正式批准。
5.泽璟生物发布公告称,公司在研产品盐酸ZG0895临床试验申请获得美国FDA批准,用于治疗晚期实体瘤。
6.华东医药发布公告称,公司全资子公司中美华东向美国FDA申报的HDM1002片的新药临床试验(IND)申请获得批准,将开展I期临床试验。
医药企业观察
1.礼新医药宣布与阿斯利康就GPRC5D靶向抗体偶联药物(ADC)LM-305项目达成全球独家授权协议。根据协议条款,阿斯利康将获得LM-305的研究、开发和商业化的独家全球许可。礼新医药将有资格获得包括首付款在内共计5500万美元的近期付款,以及最高达5.45亿美元的潜在开发和商业里程碑付款,外加全球净销售额的分级特许权使用费。
2.大睿生物宣布与康诺亚达成合作,共同研发创新siRNA药物以治疗慢性肾炎。根据协议,大睿生物将使用其RAZOR平台来发现和寻找针对慢性肾炎相关新靶点的siRNA先导化合物,康诺亚将贡献其临床研究和转化医学专业知识和能力。未来,双方将进一步共同开发和商业化从这些发现工作中产生的候选产品。
3.特宝生物与美国Aligos Therapeutics,Inc.拟签署一项利用核酸技术治疗肝炎的研究合作与开发协议。根据协议,特宝生物可从Aligos获得在中国区域对该核酸技术进行开发和商业化的独家选择权。特宝生物将就协议项下的合作研发和技术许可向Aligos支付共计700万美元的预付款和研究合作资金,并分阶段支付基于许可技术的产品开发、上市销售里程碑费用(最高不超过1.09亿美元)以及按净销售额的一定比例计算的特许权使用费。
4.恒瑞源正宣布完成超2亿元C轮融资。紫金港资本作为本轮主要投资机构继续加投,恒瑞医药、中科科创等跟投。据悉,恒瑞源正由恒瑞医药及源正细胞于2015年在上海创立,是一家专注实体瘤的免疫细胞治疗公司。
5.药物牧场宣布完成C轮首批融资,融资总额为2700万美元。本轮融资由数字医疗产业基金YD Capital领投,嘉善国投和贝达基金跟投,原股东苇渡创投和德同资本继续加持。此轮融资将用于该公司继续开展DF-006的临床试验,并将在研管线中的DF-003推进到I期临床试验。
药品集中采购
1.上海市医药集中招标采购事务管理所发布《关于本市进一步做好国家医保药品及医用耗材分类代码核对工作的提示》。《提示》指出,所有在上海挂网采购的药品均需进行国家编码核对工作。企业未在规定时间内核对确认国家编码的药品,暂停挂网采购资格。各企业应定期对自身产品编码进行日常核查,对于主要信息发生变更的要及时申报维护。各相关企业登录耗材资证系统,进入“企业-信息维护-国家耗材编码映射核对”功能,对国家编码映射的信息予以确认,并明确该编码所对应的27位耗材编码范围(原上海统编编码对应的规格型号范围)。本次核对工作截止时间为2023年5月30日。
2.湖北省医保局发布《省医疗保障局关于调整部分挂网药品价格信息的通知》,调整27个已挂网药品的挂网价,涉及15家企业20个通用名。
3.江西省医药价格和采购服务中心发布《关于公示、公布部分带量采购非中选药品价格申报信息和挂网目录的通知》,公示内容为部分纳入相关批次国家带量采购江西地区非中选药品、国家组织集采(第1-4批)协议期满后江西接续、赣粤豫鄂四省联盟带量采购等集采项目非中选药品的价格申报情况;公布内容为前期已公示无异议的部分纳入国家带量采购江西地区非中选药品、赣粤豫鄂四省联盟带量采购非中选药品和国家组织集采(第1-4批)协议期满后江西接续等集采项目非中选药品挂网目录及申报采购价格。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐