每周医药看点(6.7—6.13)
- 2023-06-15 09:22
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 倍他司汀制剂说明书内容修订;CDE发布《非阿片类术后镇痛新药临床试验设计技术指导原则》……6月7日—6月13日,医药行业的这些动态值得关注。
行业政策动态
1.国家药监局发布公告,决定对倍他司汀制剂(包括甲磺酸倍他司汀片、盐酸倍他司汀片、盐酸倍他司汀口服液、盐酸倍他司汀口服溶液、盐酸倍他司汀注射液、盐酸倍他司汀氯化钠注射液、注射用盐酸倍他司汀)说明书中的【不良反应】【禁忌】【注意事项】【孕妇及哺乳期妇女用药】【儿童用药】【药物相互作用】【药物过量】项进行统一修订。
2.国家医保局就《2023年国家基本医疗保险、工伤保险和生育保险药品目录调整工作方案(征求意见稿)》及相关文件公开征求意见。2023年药品目录调整范围包括:2018年1月1日至2023年6月30日期间,经国家药监部门批准上市的新通用名药品,或新增适应证/功能主治发生重大变化的药品;2023年6月30日前获批上市的鼓励仿制药品目录或鼓励研发申报儿童药品、罕见病用药;纳入《国家基本药物目录(2018年版)》的药品;2023年12月31日协议到期的谈判药品等。
3.国家药监局综合司发布《〈中药材生产质量管理规范〉监督实施示范建设方案》(以下简称《方案》)。根据《方案》,国家药监局决定开展中药材《中药材生产质量管理规范》(GAP)监督实施示范建设工作,由安徽、广东、四川、甘肃省药品监管部门作为任务承担单位推进示范建设,其他省级药品监管部门可根据工作需要主动开展。示范期间,每个示范省份实现中药生产企业(中药饮片、中药配方颗粒生产企业和中成药上市许可持有人)使用5—10种符合GAP的中药材。
4.国家药监局药品审评中心(CDE)发布《非阿片类术后镇痛新药临床试验设计技术指导原则》。《指导原则》适用于开发目标为术后镇痛的非阿片类新药的临床试验设计。作用于外周阿片受体、不影响中枢神经系统的术后镇痛药物的临床试验设计也可参考本指导原则。需要开展桥接性研究的仿制非阿片类镇痛药物也可以参考临床试验设计的技术要点。
5.CDE就《化学仿制药参比制剂目录(第七十一批)》(征求意见稿)公开征求意见,涉及丁丙诺啡纳洛酮舌下膜等药品。
6.CDE网站公示19个仿制药一致性评价任务,涉及酮咯酸氨丁三醇注射液等药品。(截至6月13日)
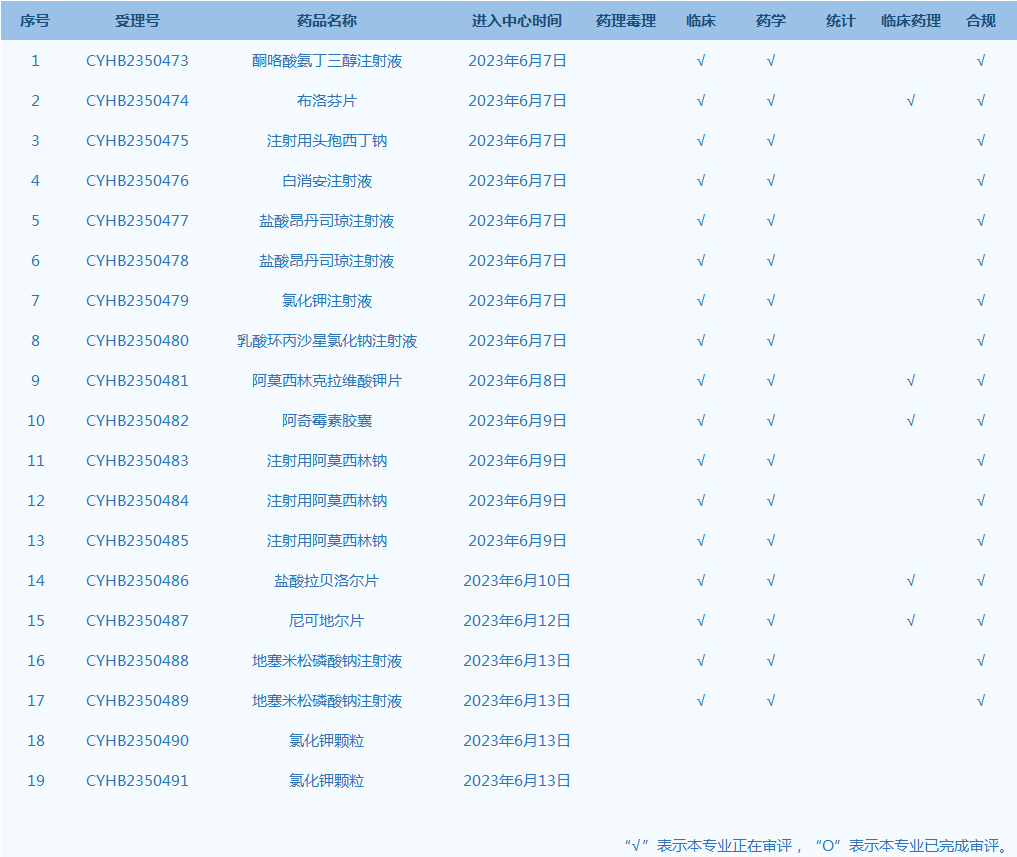
产品研发上市信息
1.国家药监局批准贝达药业股份有限公司申报的1类创新药伏罗尼布片(商品名:伏美纳)上市。该药品与依维莫司联合,用于既往接受过酪氨酸激酶抑制剂治疗失败的晚期肾细胞癌患者。
2.国家药监局批准广东思济药业有限公司申报的中药1.1类创新药参郁宁神片上市。该药品益气养阴,宁神解郁。适用于轻、中度抑郁症中医辨证属气阴两虚证。
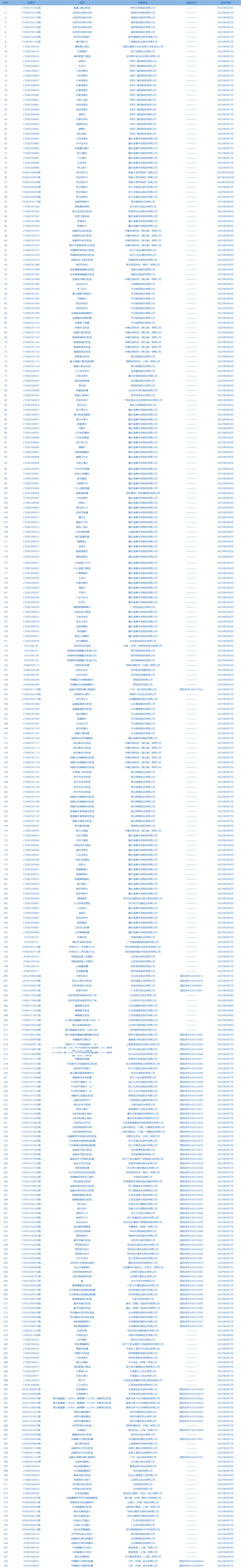
3.国家药监局发布5期药品批准证明文件送达信息,共包括329个受理号,涉及浙江华海药业股份有限公司等企业。(截至6月13日)
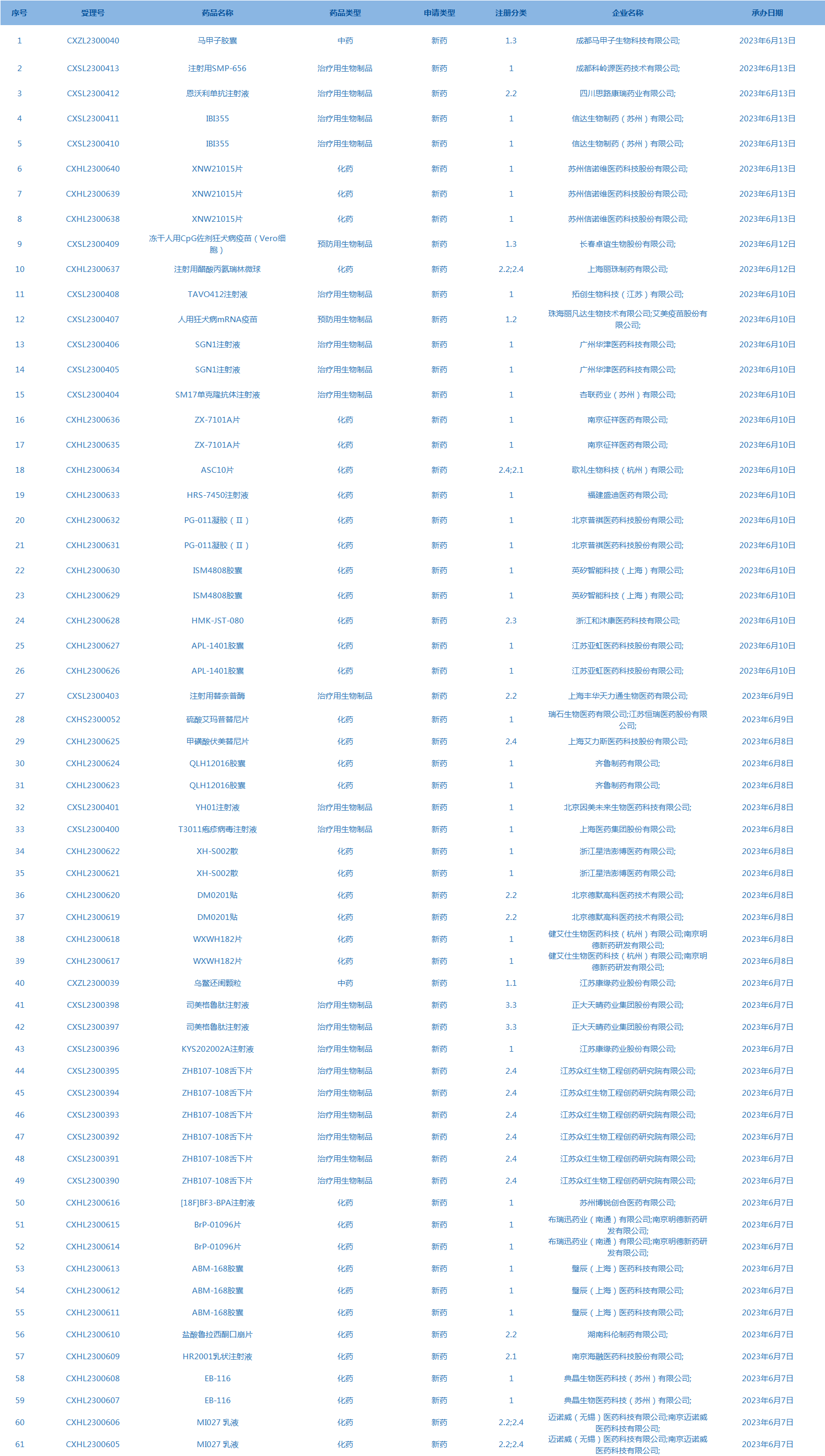
4.CDE承办受理61个新药上市申请,包括注射用SMP-656等药品。(截至6月13日)
5.健友股份发布公告称,公司子公司健进制药收到美国食品药品管理局(FDA)签发的注射用盐酸苯达莫司汀,25mg/瓶和100mg/瓶,单剂量的新药简略申请(ANDA)最终批准通知;公司子公司香港健友向美国FDA申报的唑来膦酸注射液,5mg/100mL (0.05 mg/mL)的ANDA申请获得批准。
6.美诺华药业发布公告称,收到欧洲药品质量管理局(EDQM)签发的关于瑞舒伐他汀钙路线Ⅱ(原料药)的欧洲药典适用性证书(CEP)。
7.和誉医药发布公告称,其创新CSF-1R抑制剂Pimicotinib(ABSK021)被欧洲药品管理局(EMA)授予优先药物资格,用于治疗不可手术的腱鞘巨细胞瘤(TGCT)患者。
8.泽璟制药发布公告称,其在研产品注射用ZGGS15临床试验申请获得美国FDA批准,用于治疗晚期实体瘤。
9.绿叶制药发布公告称,公司产品血脂康胶囊在乌兹别克斯坦获批上市。
10.前沿生物发布公告称,公司产品艾可宁收到哈萨克斯坦卫生部核准签发的药品注册证书。
11.石药集团宣布,其开发的抗体偶联药物CPO301获得美国FDA授予快速通道资格,用于治疗复发/难治性或EGFR靶向治疗无效的转移性EGFR突变非小细胞肺癌患者。
医药企业观察
1.普洛药业宣布与泽璟制药签署战略合作框架协议,将开展CDMO项目的长期合作。
2.药明生基与茂行生物美国公司T-MAXIMUM Pharmaceutical Inc共同宣布达成战略合作协议,药明生基将为茂行生物的MT-027通用型CAR-T细胞产品在美国提供一体化测试、工艺开发、申报批生产及IND申报等全流程服务。
3.阳光诺和发布公告称,公司全资子公司北京诺和德美医药技术有限公司、公司关联方赵凌阳先生及其他投资人拟共同出资人民币3000万元设立南京诺和欣医药科技有限公司(最终以市场监督管理部门核准的名称为准)。其中,诺和德美拟认缴货币出资1560万元,赵凌阳先生拟认缴货币出资540万元。
药品集中采购
1.安徽省药监局、医保局、卫健委联合发布《关于执行凝血类、心梗类临床检验试剂集中带量采购中选结果的通知》。此次集采中选结果将于2023年7月1日起执行,采购周期为2年,采购周期届满后,可根据市场发展变化、采购和供应等实际情况延长采购期限。产品范围包括凝血六项检验试剂:凝血酶原时间(PT)、凝血酶时间(TT)、活化部分凝血活酶时间(APTT)、纤维蛋白原(FIB)、D-二聚体(D-Dimer)、纤维蛋白(原)降解产物(FDP);心梗三项(POCT检测方式)检验试剂:肌红蛋白、肌钙蛋白(I或T)、肌酸激酶同工酶。
2.河南省医保局发布《关于做好2023年6月底药品协议期满接续和使用工作的通知》。《通知》指出,国家组织药品集采第二批采购周期3年、第四批采购周期2年的中选产品,协议期满后延长协议期至2023年12月31日,中选企业和医疗机构继续执行原集采落地文件;国家组织药品集采第四批采购周期3年的中选产品,湖北中成药联盟中选产品,江西四省抗生素联盟注射用哌拉西林钠中选产品,河南十三省联盟采购周期2年的中选产品,按要求组织下一采购年度医药机构报量及购销合同的签订;河南十四省联盟药品集采部分中选产品,国采第二、第四批河南十三省联盟接续采购药品集采采购周期1年的中选产品,6月30日协议期满后征求相关中选企业意见,确认接续的中选产品继续执行原带量采购政策,组织报量和签订协议。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐













