每周医药看点(6.28—7.4)
- 2023-07-06 10:34
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 国家药监局成立珍稀濒危中药材替代品监管政策与技术要求研究专家工作组;国家医保局就《谈判药品续约规则(2023年版征求意见稿)》及《非独家药品竞价规则(征求意见稿)》公开征求意见……6月28日—7月4日,医药行业的这些动态值得关注。
行业政策动态
1.国家药监局发布公告,决定适用《M10:生物分析方法验证及样品分析》国际人用药品注册技术协调会指导原则(以下简称M10)问答文件和常见问题解答文件。自2023年7月29日起开始的相关研究(以生物样品分析原始记录时间点为准),均适用M10问答文件和常见问答解答文件。
2.国家医保局就《谈判药品续约规则(2023年版征求意见稿)》及《非独家药品竞价规则(征求意见稿)》公开征求意见。其中,《非独家药品竞价规则(征求意见稿)》提出,药品通过竞价纳入医保目录的,取各企业报价中的最低者作为该通用名药品的支付标准。如企业报价低于医保支付意愿的70%,以医保支付意愿的70%作为该药品的支付标准。
3.国家药监局综合司发布通知,决定在中药管理战略决策咨询委员会下设立珍稀濒危中药材替代品监管政策与技术要求研究专家工作组,旨在加强珍稀濒危野生药用动植物保护,支持珍稀濒危中药材替代品的研究和开发利用。专家工作组由来自全国高校、科研院所、行业协会等16家单位的20名专业人员组成,涵盖了中医临床,中药资源、药学、药理毒理、标准、检验、审评,以及生物酶工程等领域。
4.国家药监局综合司就《药品说明书适老化改革试点工作方案(征求意见稿)》及相关配套文件公开征求意见,征求意见截止时间为2023年7月28日。征求意见内容表示,国家药监局决定在老年患者常用的部分口服、外用药品制剂中开展药品说明书适老化改革试点,以优化药品说明书管理,鼓励药品上市许可持有人积极探索,解决药品说明书“看不清”等问题。
5.国家药监局综合司就《药物临床试验机构监督检查办法(试行)(征求意见稿)》公开征求意见。《征求意见稿》共6章41条,包括总则、检查机构和人员、检查程序、检查有关工作衔接、检查结果的处理、附则,适用于药品监管部门对试验机构备案及开展药物临床试验活动遵守相关法律法规、执行《药物临床试验质量管理规范》等情况实施检查、处置等。该文件总结试验机构备案管理以来的监管工作经验,拟进一步明确相关方职责,明确检查工作制度化要求,优化监督检查工作程序,建立检查有关工作衔接机制,明确了不同检查结果的处理方式,强化对发现问题的查处。
6.国家药监局综合司公开征求《药品检查管理办法(试行)》(以下简称《办法》)部分条款修订意见,征求意见截止时间为2023年7月10日。《办法》发布并实施于2021年5月,共十章70条。此次征求意见的部分条款修订对照表显示,共有10个条款拟进行修订,其中9条涉及检查程序,1条涉及检查结果的处理。此次修订取消了现场检查结论和综合评定结论中“基本符合要求”这一项,检查评定标准更加严格。
7.国家药监局综合司发布《关于提前终止有关中药品种保护的通知》,自通知印发之日起,神威药业集团有限公司降脂通络软胶囊不再按国家中药保护品种管理,不得冠以“国家中药保护品种”的称谓。
8.国家药监局药品审评中心就《抗肿瘤药物说明书安全性信息撰写技术指导原则(征求意见稿)》公开征求意见,进一步统一说明书安全性信息撰写规范,为安全用药提供保障。征求意见时限为自发布之日起一个月。
9.国家药监局食品药品审核查验中心发布《中药材GAP实施技术指导原则》(以下简称《指导原则》)和《中药材GAP检查指南》(以下简称《检查指南》),以促进中药材规范化发展,推进中药材GAP(《中药材生产质量管理规范》)有序实施,强化中药材质量控制,从源头提升中药质量。《指导原则》系统全面地展示了新版中药材GAP的修订背景、修订过程及相关问题的解答,以期为相关中药企业实施新版中药材GAP提供重要指导和帮助,同时也为药监部门的监管、专家学者的研究、科研院所的科研提供指引。《检查指南》明确了中药材GAP审核检查标准和检查要点,为企业自检、专家或第三方审查提供参考。
10.国家药监局药品审评中心网站公示27个仿制药一致性评价任务,涉及阿莫西林克拉维酸钾片等药品。(截至7月4日)
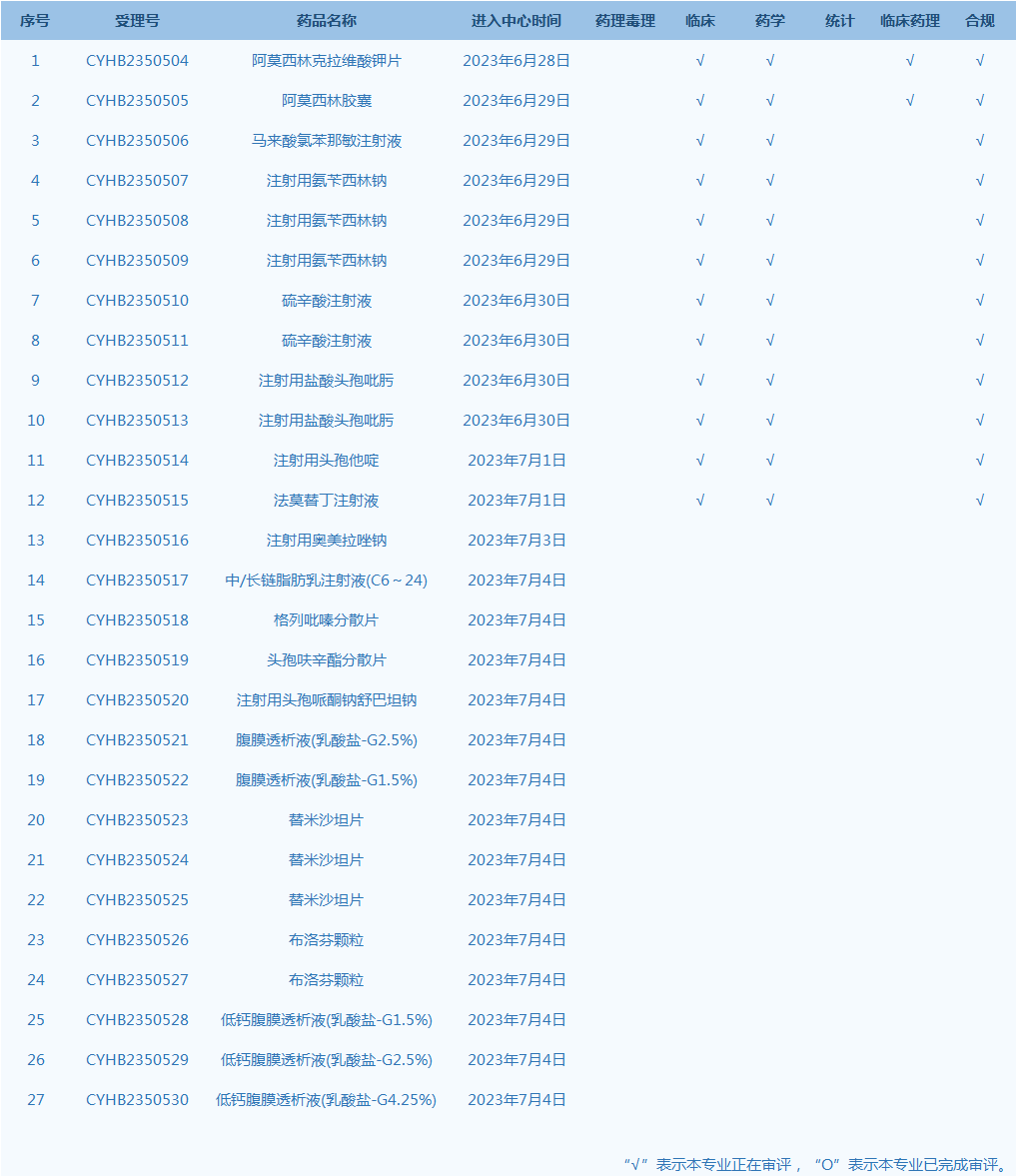
产品研发上市信息
1.国家药监局批准江苏豪森药业集团有限公司申报的1类创新药培莫沙肽注射液(商品名:圣罗莱)上市。该药适用于未接受红细胞生成刺激剂(ESA)治疗的成人非透析患者,及正在接受短效促红细胞生成素(EPO)治疗的成人透析患者(本品不适用于在需要立即纠正贫血的患者中替代红细胞输注)。
2.国家药监局通过优先审评审批程序附条件批准南京驯鹿生物医药有限公司申报的伊基奥仑赛注射液(商品名:福可苏)上市。该药用于治疗复发或难治性多发性骨髓瘤成人患者,既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。
3.国家药监局批准厦门特宝生物工程股份有限公司申报的拓培非格司亭注射液(商品名:珮金)上市。该药适用于非髓性恶性肿瘤患者在接受容易引起发热性中性粒细胞减少症的骨髓抑制性抗癌药物治疗时,降低以发热性中性粒细胞减少症为表现的感染发生率。
4.国家药监局批准齐鲁制药有限公司申报的1类创新药伊鲁阿克片(商品名:启欣可)上市。该药适用于既往接受过克唑替尼治疗后疾病进展或对克唑替尼不耐受的间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗。
5.国家药监局批准eVENUS PHARMACEUTICAL LABORATORIES INC.申报的1类创新药奥特康唑胶囊上市。该药品用于治疗重度外阴阴道假丝酵母菌病(VVC)。
6.国家药监局批准江苏恒瑞医药股份有限公司申报的1类创新药磷酸瑞格列汀片(商品名:瑞泽唐)上市,该药适用于改善成人2型糖尿病患者的血糖控制。
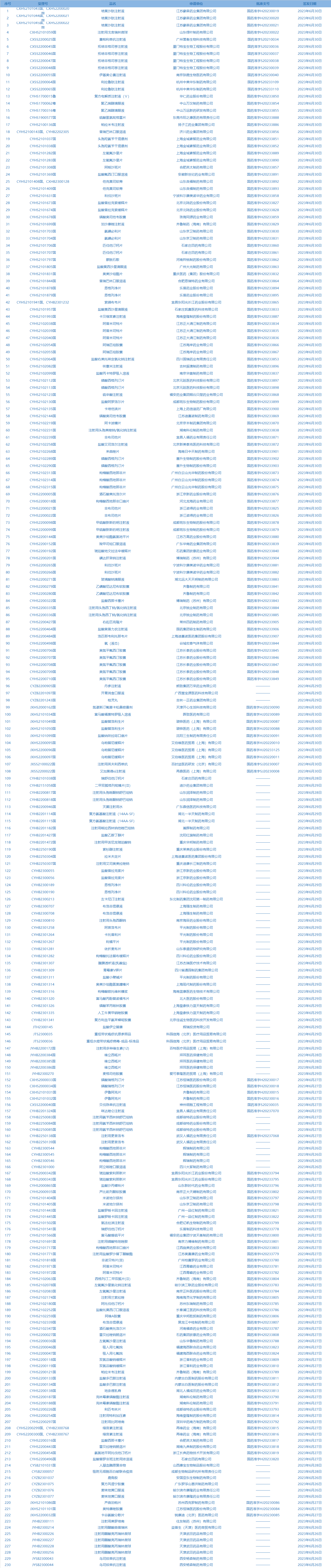
7.国家药监局发布3期药品批准证明文件送达信息,共包括230个受理号,涉及西安杨森制药有限公司等企业。(截至7月4日)
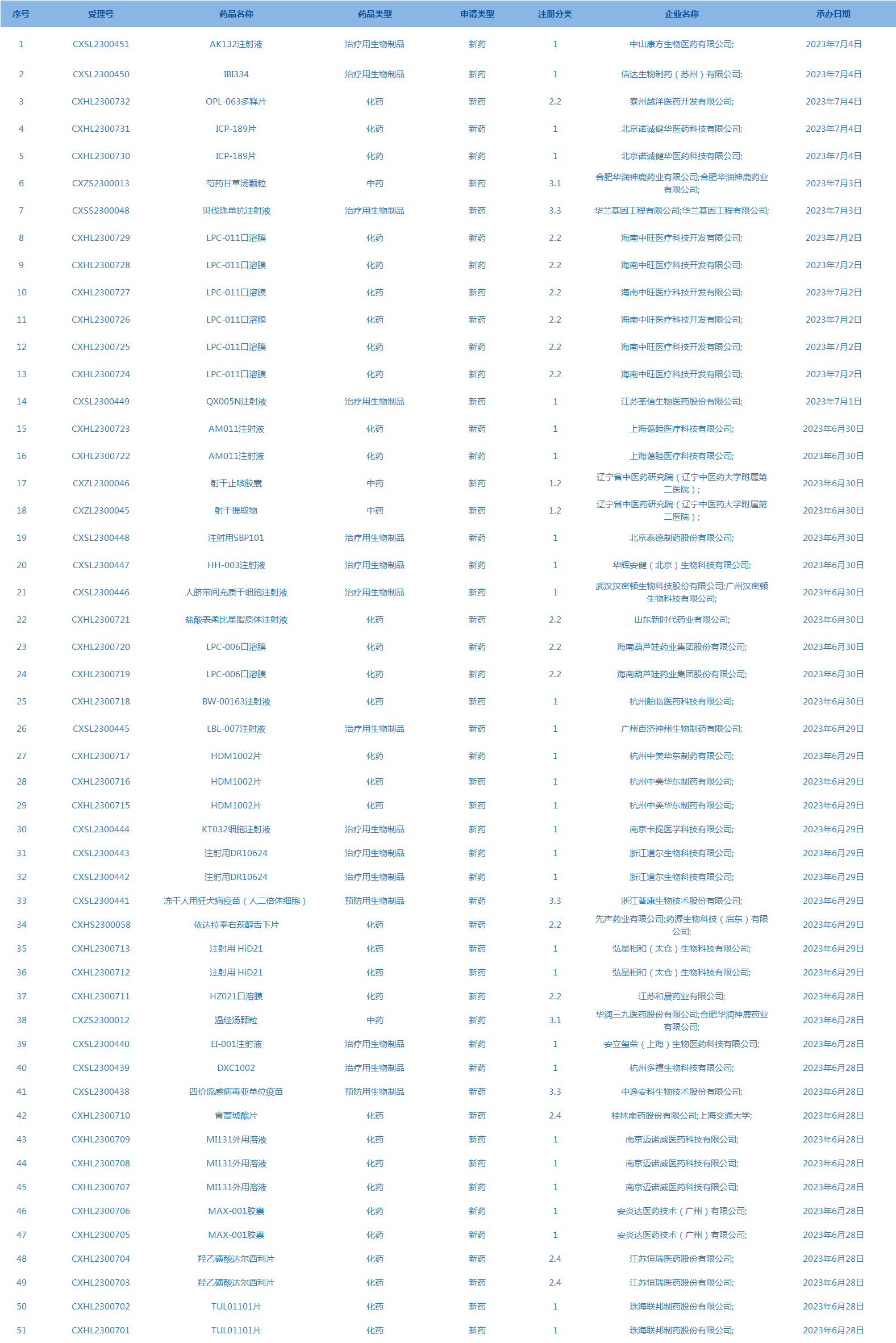
8.国家药监局药品审评中心承办受理51个新药上市申请,包括AK132注射液等药品。(截至7月4日)
医药企业观察
1.健友股份发布公告称,公司全资子公司香港健友(以下简称被许可方代表)及香港健友控股子公司Meitheal Pharmaceuticals, Inc.(以下简称被许可方)拟与Xentria签署《许可、开发与商业化协议》。根据协议,Xentria将授予被许可方在许可区域开发和商业化XTMAB的独占许可,并向被许可方/被许可方代表转让与XTMAB相关专利、技术和专有知识的所有权。
2.博济医药宣布与鲲鹏生物签订技术服务(委托)合同,合同约定鲲鹏生物委托博济医药进行“门冬胰岛素注射液”临床试验研究的相关服务。合同总金额为人民币5358万元(含税)。
3.誉衡药业发布公告,公司拟将持有的参股公司誉衡生物42.12%股权以人民币2.40亿元的交易价格出售给普晟普利。本次交易完成后,誉衡药业将不再持有誉衡生物股权。
4.6月29日,来凯医药(股票代码:2105.HK)成功登陆香港资本市场主板。该公司是一家以创新药研发为核心的全球化生物科技公司,致力于开发抗肿瘤和肝纤维化的创新治疗药物。
5.龙津药业发布公告,公司全资子公司龙津梵天将向参股公司上海柔以时生物科技有限公司以现金方式增资3000万元,其持股比例由增资前的10%增加至75.61%。
6.昂利康与阳光诺和共同宣布签署技术开发合同,将共同投资开发NHKC-1项目,合同里程碑付款累计总金额为7500万元(含税)。
7.先通医药宣布完成超11亿元人民币新一轮融资。本轮融资由国投创业、金石投资、国调基金等共同参与投资,国寿股权和荷塘创投等现有股东继续增持股份,凯乘资本担任本次交易的独家财务顾问。本轮募集资金将继续用于公司诊断和治疗性放射性药物的研究、开发和临床应用。
药品集中采购
1.北京市医保局发布《关于进一步加强本市药品、医用耗材阳光采购管理有关事项的通知》。《通知》明确,除麻醉药品、精神药品、防治传染病和寄生虫病的免费用药、国家免疫规划疫苗、计划生育药品、体外诊断试剂、医疗用毒性药品、放射性药品等特殊管理药品外,临床采购使用的所有化学药品、生物制剂、中成药、中药饮片和中药配方颗粒均属于北京市药品阳光挂网采购范围。要做到全品种全用量网上采购,坚决禁止网下采购行为。
2.浙江省药品医用耗材集中带量采购办公室就《浙江省公立医疗机构第四批药品集中带量采购文件(征求意见稿)》公开征求意见。《征求意见稿》明确,每个品种按照经医疗机构确认后的2022年度药品总用量的70%作为约定采购量。约定采购量以外的剩余用量,医疗机构优先采购中选产品,也可通过浙江省药械采购平台采购其他价格适宜的挂网品种。
(刘思慧整理)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐













