每周医药看点(7.5—7.11)
- 2023-07-13 14:08
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 国家药监局发布《药品标准管理办法》;《临床试验中的药物性肝损伤识别、处理及评价指导原则》《人乳头瘤病毒疫苗临床试验技术指导原则(试行)》等文件发布……7月5日—7月11日,医药行业的这些动态值得关注。
行业政策动态
1.国家药监局发布《药品标准管理办法》(以下简称《办法》)。这是我国第一部关于药品标准管理专门的法规文件,自2024年1月1日起施行。《办法》适用于国家药品标准、药品注册标准和省级中药标准的管理。《办法》明确三类标准的范围;指出国家药品标准和省级中药标准管理工作实行政府主导、企业主体、社会参与的工作机制,药品注册标准的制定和修订工作应当强化药品上市许可持有人的主体责任;鼓励社会团体、企业事业组织以及公民积极参与药品标准研究和提高工作,加大信息、技术、人才和经费等投入,并对药品标准提出合理的制定和修订意见和建议。
2.国家药监局、海关总署公布奥赛利定麻醉药品的海关商品编号,自2023年7月1日起施行。
3.国家药监局药品审评中心发布《临床试验中的药物性肝损伤识别、处理及评价指导原则》。该指导原则主要用于指导药物临床试验中药物性肝损伤风险的临床评价,提出了药物性肝损伤的监测、评估及处理程序框架,目的在于保障受试者安全,同时获得安全性信息以评估试验药物的风险特征。该指导原则不涉及上市后应用阶段的药物性肝损伤评价。
4.国家药监局药品审评中心发布《人乳头瘤病毒疫苗临床试验技术指导原则(试行)》。该指导原则主要阐述以子宫颈癌为目标适应证的临床试验考虑,其他适应证可参考执行。该指导原则适用于拟在中国上市注册、以HPV主要衣壳蛋白L1组装为VLP的预防用疫苗;其他类型的预防用HPV疫苗(如以次要衣壳蛋白L2为靶点的预防用疫苗、嵌合VLP疫苗等)根据具体情况也可参考;不适用于治疗性HPV疫苗。
5.国家药监局药品审评中心发布《关于加快古代经典名方中药复方制剂沟通交流和申报的有关意见(征求意见稿)》(以下简称《征求意见稿》),对加强研发关键节点的沟通交流、实行申报资料阶段性递交公开征求意见。《征求意见稿》表示,药审中心对于按古代经典名方目录管理的中药复方制剂(中药3.1类)采取早期介入、研审联动等措施,加快相关品种的研发和申报进度。建议申请人在基准样品研究基本完成后、制备工艺确定后/开展毒理研究前、申请上市许可前等研发关键节点与药审中心进行沟通交流,并提出了3个关键节点沟通交流相应资料要求。征求意见时限为自发布之日起1个月。
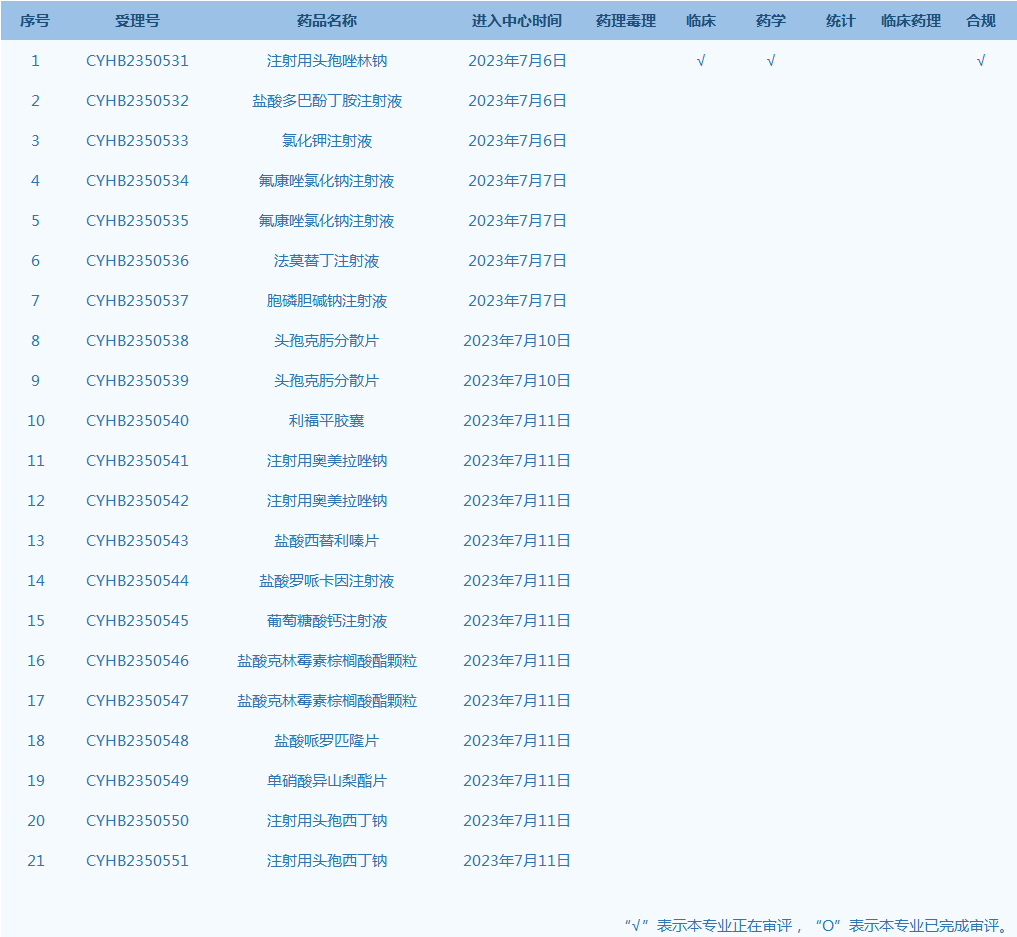
6.国家药监局药品审评中心网站公示21个仿制药一致性评价任务,涉及注射用头孢唑林钠等药品。(截至7月11日)
产品研发上市信息
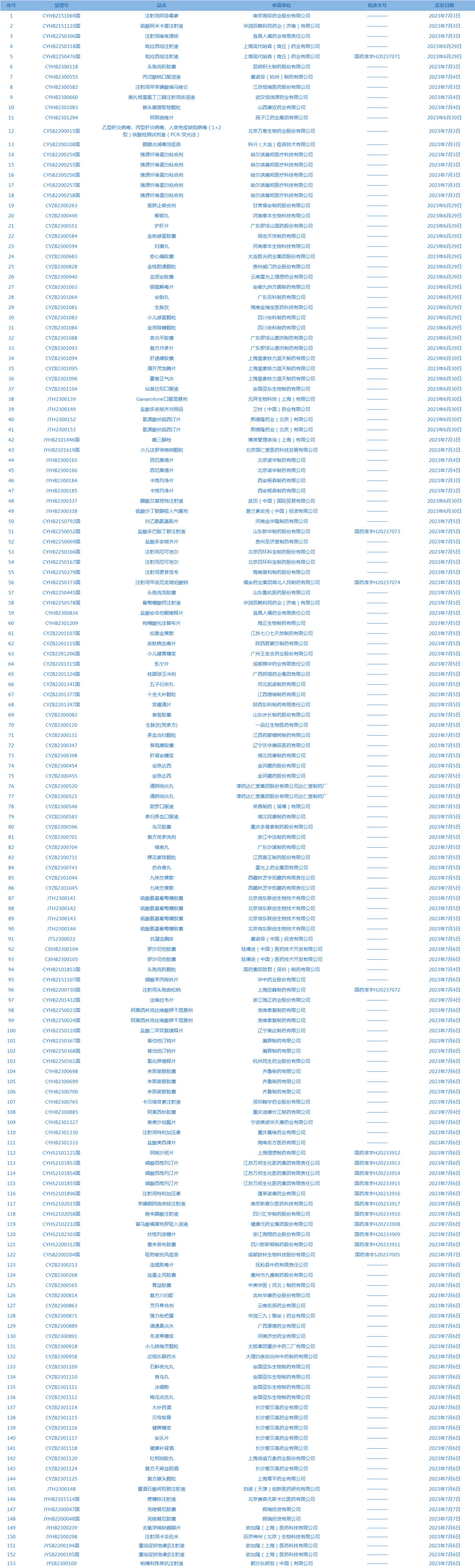
1.国家药监局发布3期药品批准证明文件送达信息,共包括153个受理号,涉及江苏恒瑞医药股份有限公司等企业。(截至7月11日)
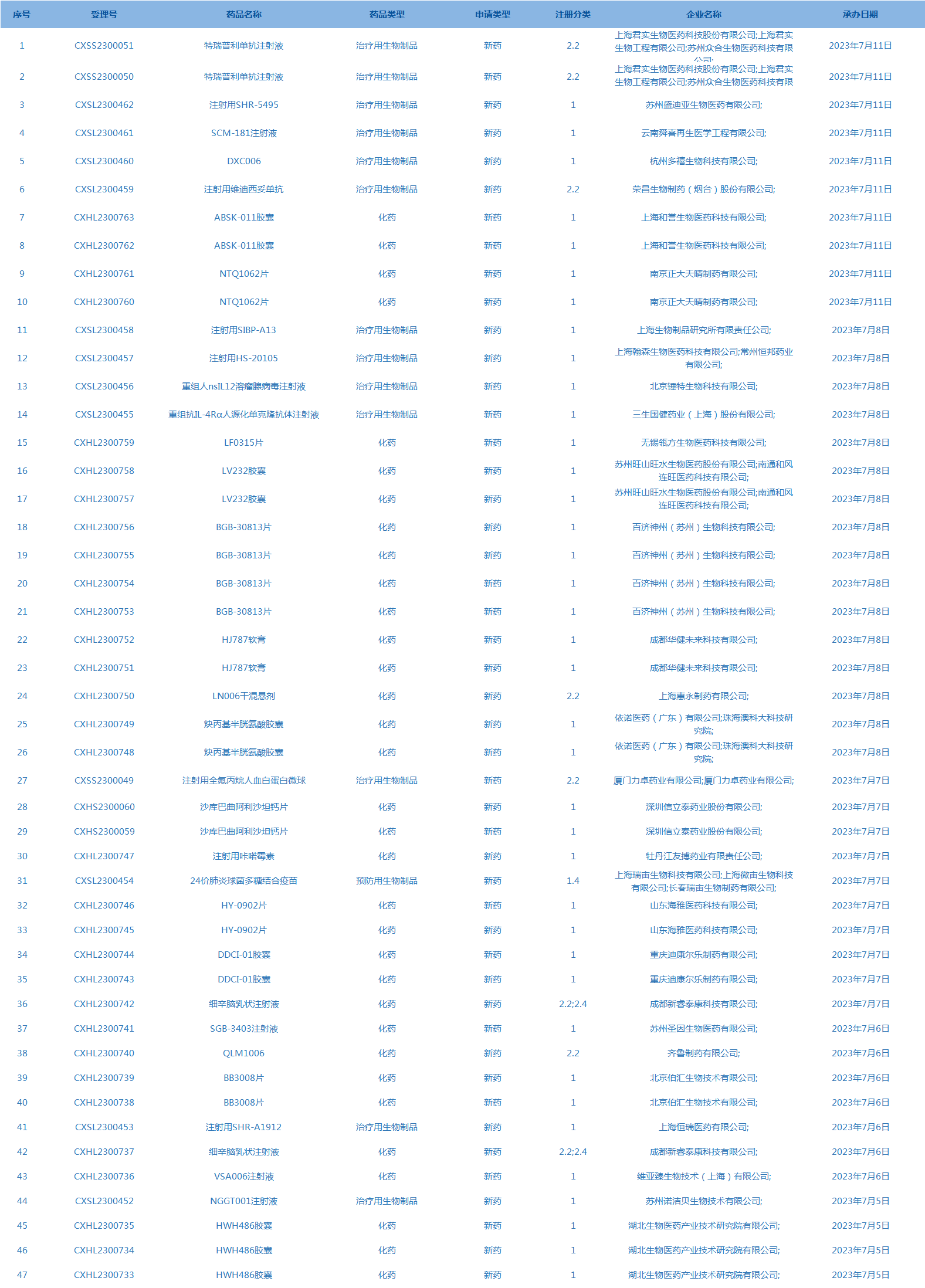
2.国家药监局药品审评中心承办受理47个新药上市申请,包括注射用SHR-5495等药品。(截至7月11日)
3.汇宇制药发布公告称,公司全资子公司Seacross Pharma (Europe) Ltd.收到德国药品和健康产品管理局核准签发的关于公司产品普乐沙福注射液的上市许可。
4.普利制药发布公告称,收到英国药品和健康产品管理局(MHRA)签发的注射用达托霉素的上市许可。
5.基石药业发布公告称,收到欧洲药品管理局(EMA)对其PD-L1抗体择捷美(舒格利单抗注射液)联合化疗一线治疗转移性非小细胞肺癌(NSCLC)的上市许可申请(MAA)的临床试验核查通知。
医药企业观察
1.百济神州和映恩生物共同宣布,双方达成一项独家选择权和授权合作协议,百济神州获得一款在研的临床前抗体偶联药物(ADC)的全球开发和商业化权利,该药物将用于治疗特定实体瘤患者。根据协议条款,映恩生物将从百济神州获得一笔首付款,并将在百济神州行使选择权后,有权获得选择权付款。此外,基于合作研究项目取得的特定研发进展、注册进展和商业化里程碑,映恩生物将有权获得高达13亿美元的额外付款,以及分级特许权使用费。在行使选择权后,百济神州将拥有这款药物在全球的开发、生产和商业化权利,而映恩生物将负责开展该药物在递交IND前的所有临床前研究,并支持百济神州未来的IND申请。
2.7月11日,科伦博泰在港交所上市。科伦博泰是一家致力于肿瘤学、免疫学及其他领域创新药物的研发、制造及商业化的生物医药公司。根据招股书,该公司本次在港交所IPO,基石投资者有RTW Funds、Laurion Capital Master Fund、TruMed、汇添富和科伦国际。
3.中国生物制药发布公告,公司英国全资子公司F-star Therapeutics Limited与武田制药达成一项战略合作并订立许可协议。该合作将利用F-star专有的全人Fcab™及四价mAb² ™平台,研究及开发用于癌症患者的新一代多特异性免疫疗法。
4.圣诺医药发布公告,公司与一家专注于RNA编辑疗法的初创生物科技公司EDIRNA Inc.建立战略合作伙伴关系,以推进和优化其专有的Edit-to-Cure Therapeutics™递送平台,针对目前未获满足临床需求疾病的治疗。
5.腾盛博药宣布与VBI Vaccines, Inc.签订许可协议,以拓展双方在乙型肝炎(HBV)领域的战略合作。根据协议及受其条款及条件规限,腾盛博药将从VBI获得BRII-179(VBI-2601)的全球独家开发和商业化权利,将BRII-179(VBI-2601)独家许可从大中华区扩大至全球市场。此外,腾盛博药还将从VBI获得PreHevbri®在大中华区及包括澳大利亚、印度尼西亚、马来西亚、新西兰、菲律宾、新加坡、韩国、泰国和越南等若干亚太国家的开发和商业化权利。
6.一品红发布公告,公司全资子公司瑞腾生物拟以自有资金2500万美元对瑞騰生物(香港)增资,其中的2100万美元将用于参与Arthrosi Therapeutics,Inc.的D轮优先股融资。上述事项完成后,瑞騰生物(香港)将获得Arthrosi新发股份360.26万股。与此同时,公司关联方Guangrun Health Industry(Hong Kong)Co.Limited将出资3500万美元认购600.43万股。
药品集中采购
1.上海联盟采购办公室发布《十五省(区、市)联盟地区药品集中采购文件》,由北京、天津、上海、浙江、安徽、福建、江西、山东、湖北、湖南、重庆、四川、云南、西藏、甘肃组成地区联盟,成立国家集采药品接续上海联盟采购办公室,开展十五省(区、市)联盟地区药品集中带量采购。具体经办工作由上海市医药集中招标采购事务管理所负责实施。此次集采的品种有49个,均是国家集采即将到期的品种。
2.广东省医保局发布《关于做好第八批国家组织药品集中采购和使用工作的通知》,明确第八批国采首年采购周期从2023年7月31日至2024年7月30日。本次国采中选并选择供应广东的头孢西丁注射剂型为湖南科伦制药有限公司的即配型粉液双室袋制剂,按《采购文件》和《第八批工作提示》有关规定,该企业该品种执行时间与下一版《国家基本医疗保险、工伤保险和生育保险药品目录》落地时间同步,协议结束时间相应调整。
(刘思慧整理)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐













