每周医药看点(9.13—9.19)
- 2023-09-21 09:15
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 小柴胡颗粒等3种药品转换为非处方药;CDE网站公示20个仿制药一致性评价任务……9月13日—9月19日,医药行业的这些动态值得关注。
行业政策动态
1.国家药监局公告小柴胡颗粒、高山红景天口服液、众生片等3种药品转换为非处方药,一并发布品种名单及非处方药说明书范本,要求相关药品上市许可持有人在2024年6月5日前就修订说明书事项向省级药品监管部门备案。按照品种名单信息,此次进行转换的小柴胡颗粒规格为每袋装3克(无蔗糖),高山红景天口服液规格为每支装10毫升,众生片规格为每片重0.3克。3种药品均为甲类非处方药。
2.国家医保局发布《关于进一步深入推进医疗保障基金智能审核和监控工作的通知》。通知显示,到2023年底前将全部统筹地区上线智能监管子系统,智能审核和监控数据准确上传国家医保信息平台,全面开展经办智能审核,规范定点医药机构服务行为,加强协议处理与行政监管、经办核查与行政执法的衔接,初步实现全国智能监控“一张网”。
3.国家药监局药品审评中心(CDE)就《化学仿制药参比制剂调整目录》(征求意见稿)公开征求意见,拟对盐酸氨溴索吸入溶液等5个品种(9个品规)参比制剂进行调整。征求意见截止日期为2023年10月7日。
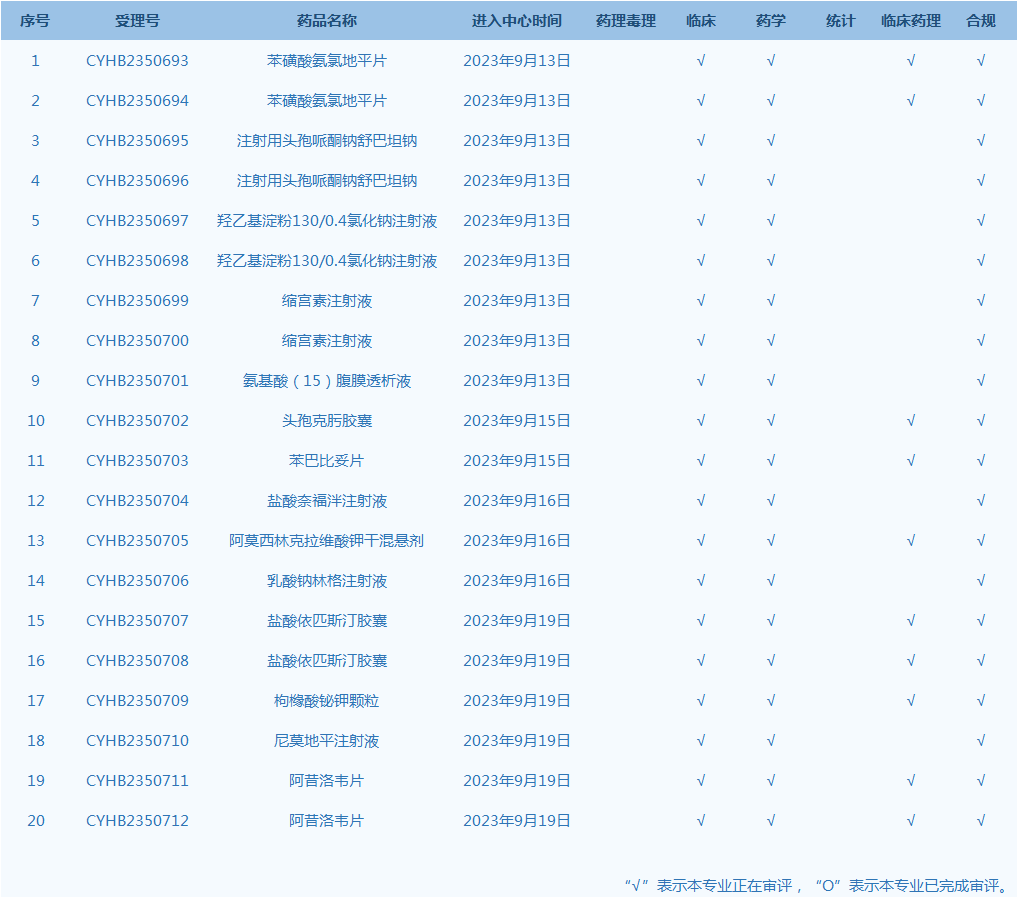
4.CDE网站公示20个仿制药一致性评价任务,涉及苯磺酸氨氯地平片等品种。(截至9月19日,详见图1)
产品研发上市信息
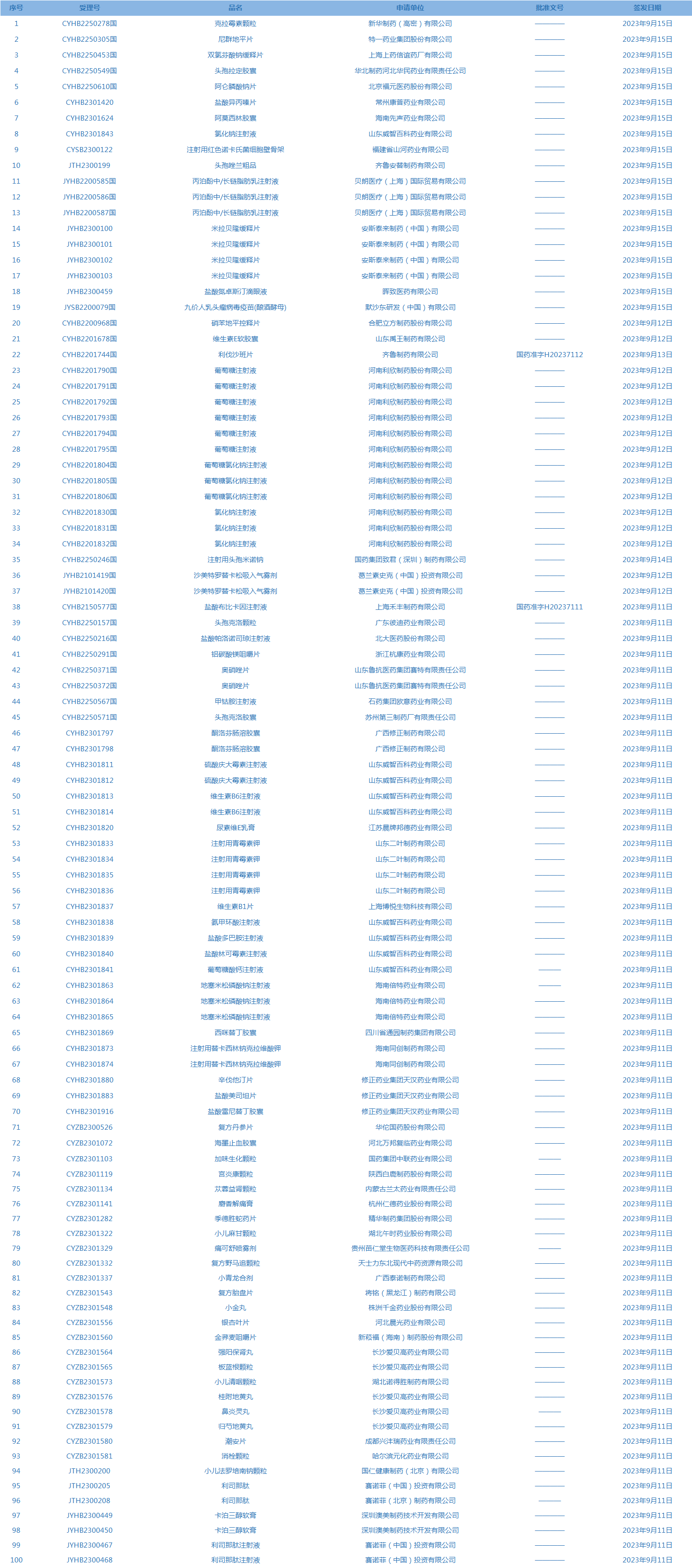
1.国家药监局发布3期药品批准证明文件送达信息,共包括100个受理号,涉及特一药业集团股份有限公司等企业。(截至9月19日,详见图2)
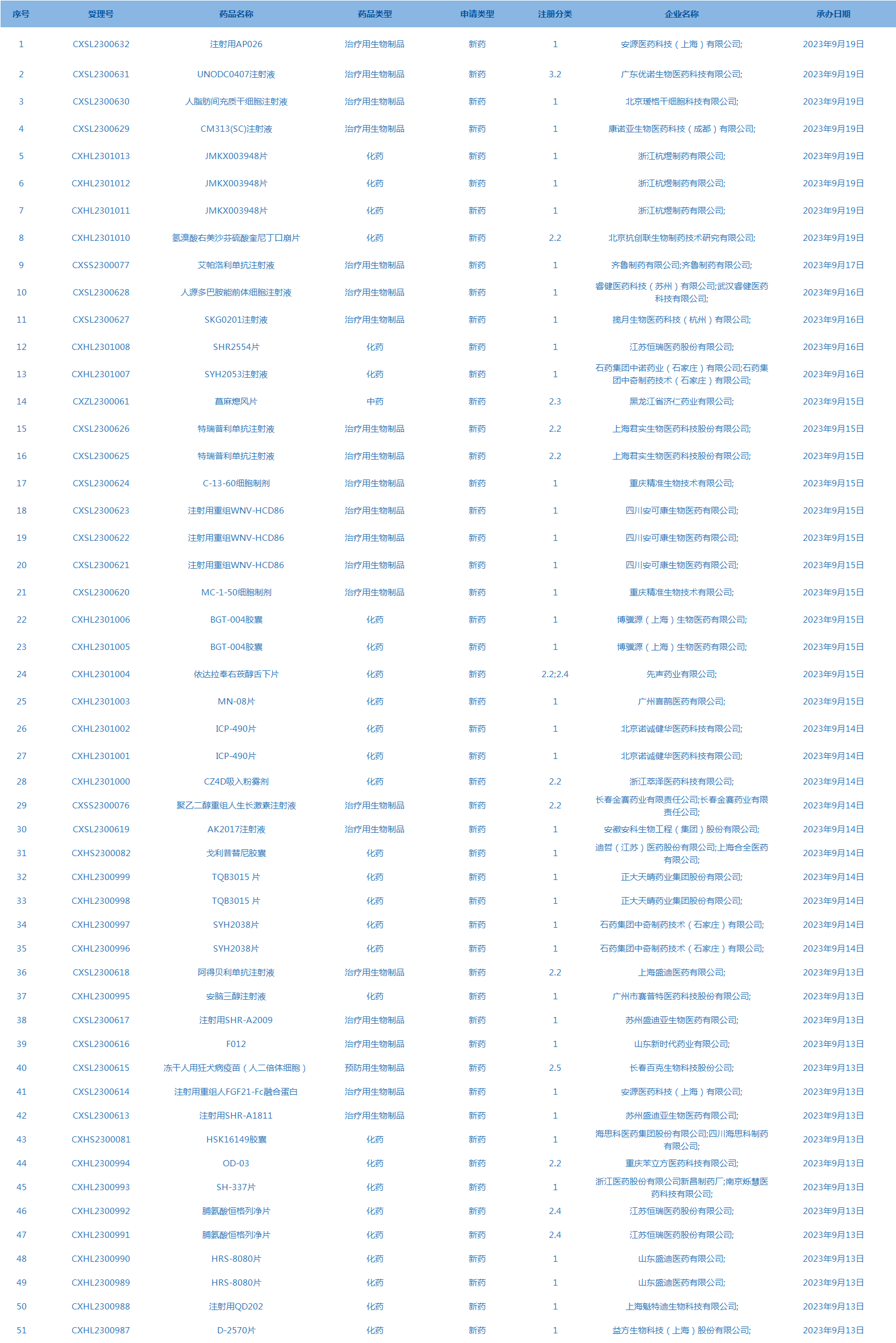
2.CDE承办受理51个新药上市申请,包括注射用AP026等药品。(截至9月19日,详见图3)
3.北陆药业控股子公司海昌药业收到韩国食品药品安全处签发的原料药产品注册证书。
4.英派药业宣布,由其自主研究发现、与Eikon Therapeutics合作开发的PARP1选择性抑制剂IMP1734已获得美国食品药品管理局(FDA)的临床试验许可,并将于2023年第四季度开展Ⅰ期临床研究。
5.易慕峰宣布其自主研发的靶向EpCAM的自体CAR-T细胞注射液产品(IMC001)近期获得美国FDA的孤儿药资格,用于治疗胃癌患者。
医药企业观察
1.科伦药业控股子公司科伦博泰与西南医科大学附属医院就放射性核素药物偶联物(RDC)TBM-001订立独占性许可协议。根据许可协议,西南医大附属医院授予科伦博泰在全球范围内研究、开发及商业化TBM-001的独家许可,且有权根据约定收取先期费用、里程碑费用、产品上市后净销售额提成及第三方分许可收益分成等若干经济利益,其中先期费用、里程碑费用合计为3850万元人民币。
2.通化东宝药业股份有限公司(以下简称通化东宝)与南京健友生化制药股份有限公司(以下简称健友股份)关于甘精、门冬、赖脯三种胰岛素注射液在美国市场的战略合作举办了签约仪式。根据协议,通化东宝与健友股份将根据美国FDA药品注册要求,共同开展上述三种胰岛素合作产品的开发和生产。同时,健友股份将获得产品上市后在美国市场独家商业化权益。
3.海森药业宣布与浙江东阳经济开发区管委会签署《投资意向书》,拟投资30亿元在东阳经济开发区内投资建设“海森药业新厂区建设项目”。该协议为投资合作意向协议,暂无需提交海森药业董事会或股东大会审议。
4.纽安津生物宣布,公司已与博爱新开源医疗签订投资协议,率先完成了5000万的新一轮融资领投方交割到账。本轮融资将助力纽安津生物自主研发的个体化肿瘤治疗性多肽疫苗注射用P01的Ⅰ期临床试验、个体化肿瘤治疗性mRNA疫苗iNeo-Vac-R01的研究者发起的临床试验(IIT),以及其他管线的快速推进。
药品集中采购
1.北京市医保局、天津市医保局、河北省医保局联合印发《2023年京津冀药品联合带量采购工作实施方案》,明确京津冀三地医保部门根据临床需求,分别研究提出纳入联合集中带量采购的药品目录,汇总形成京津冀联合带量采购药品目录,供三地选择参加。采购方式分为带量竞价、带量联动、带量谈判、短缺药品订单式采购。
2.江西省医保局发布《关于公示我省第四批未过评药集采拟集采品种的通知》,共包括法莫替丁注射剂、烟酰胺注射剂、维生素B6注射剂等25个拟集采品种。
3.陕西省公共资源交易中心发布《关于开展省际联盟药品集中带量采购报名工作的通知》。通知显示,陕西、黑龙江、安徽、江西、河南、湖南、广西、贵州、西藏、宁夏、青海、新疆、新疆生产建设兵团等13省(区、兵团)自愿组成省际联盟,开展省级药品集中带量采购。此次集采只接受国内药品生产企业、药品上市许可持有人和境外药品上市许可持有人境内代理人的申报。集团公司所属企业须以生产企业为单位分别申报。
(刘思慧整理)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐













