2024年3月份美国Clinicaltrial数据库临床试验数据显示:单抗药物临床试验数量飙升 中国贡献六项研究
- 2024-05-09 14:32
- 作者:陈宇哲
- 来源:中国医药报
根据美国Clinicaltrial数据库数据,2024年3月份,全球新增由企业资本主导的临床试验总数为733项,新开临床试验数量显著上升,较2月份增长27.04%。单月新增临床试验数量低于2023年同期水平,同比下降5.66%。值得注意的是,当月围绕单抗药物新开展的临床试验数量大幅上升,其中有6项由中国企业开展。
新开临床试验整体情况
3月份,新开临床试验数量最多的企业(机构)是阿斯利康,申报数量为20项;随后为默沙东和百时美施贵宝,分别为14项和13项。在全球新开临床试验数量排名前十的企业中,增幅最大的是诺华,新开临床试验数量从上月的2项增至当月的9项,月增幅为350%;其次是礼来和武田,增幅均为233.33%。排名前十的企业中,新开临床试验数量下滑幅度最大的企业为艾伯维,降幅为37.5%。
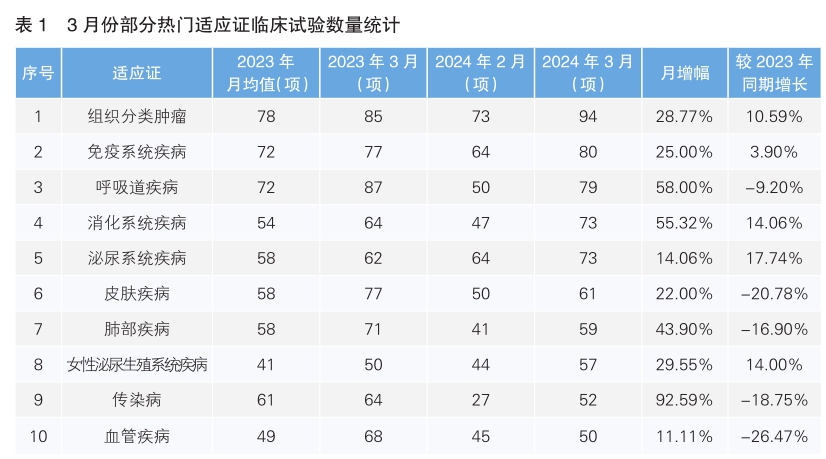
从3月份新增临床试验热门适应证领域来看,组织分类肿瘤仍为最主要的热门研发领域,试验数量为94项,相较2月份增长28.77%;其次为免疫系统疾病,环比增长25%。月增幅最高的热门适应证为传染病,单月增幅为92.59%。月增幅最低的热门适应证为血管疾病,单月增幅为11.11%。相较于2023年同期,同比增幅最为显著的为泌尿系统疾病,增长17.74%;同比降幅最为显著的是血管疾病,降幅为26.47%。(详见表1)
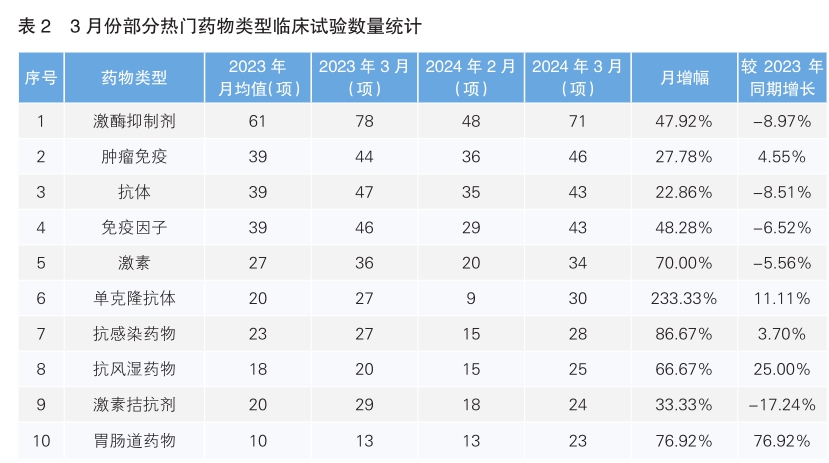
对新增临床试验药物类型进行统计后发现,3月份最为热门的药物类型仍为激酶抑制剂,环比增长47.92%,但同比下降了8.97%;其次为肿瘤免疫药物,环比增长27.78%,同比增长4.55%。月增幅最高的药物类型为单克隆抗体药物,增幅为233.33%,同比增长了11.11%。相较于2023年同期月降幅最大的药物类型是激素拮抗剂,同比下降了17.24%。(详见表2)
对新开临床试验的申请国家和地区进行统计后发现,当月美国仍为临床试验开展最多的国家,但数量环比下降了3.42%。其次是中国,新开临床试验数量与2月份持平。相较于2月份,热门国家和地区多数新开临床试验数量下降,数量增长的国家有澳大利亚、法国和英国,其中英国的月增幅最高,为45%;德国的月降幅最大,为30.95%;同比增幅最高的为澳大利亚。
单抗药物临床试验赛道火热
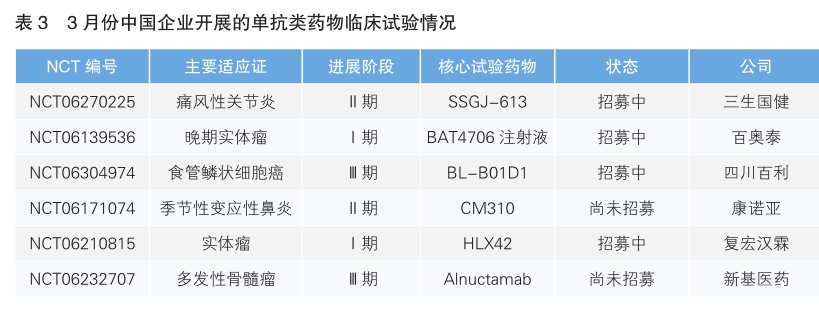
对快速增多的单克隆抗体类药物的临床试验进行进一步检索可知,当月开展该类临床试验最多的国家为美国,有14项;其次为中国,共有6条记录。(详见表3)
SSGJ-613是三生国健研发的具有全新可变区序列的抗IL-1β抗体。IL-1β属于IL-1家族成员,是炎症信号通路的关键分子,它不仅能发挥促炎作用,还可加强T淋巴细胞、B淋巴细胞的反应,因此是自身炎症性疾病的重要治疗靶点。SSGJ-613通过特异性结合IL-1β,能够有效阻断IL-1β介导的信号传导,抑制其产生的炎症效应,因此具有治疗多种自身免疫性炎症疾病的潜力。新开临床试验主要适应证为痛风性关节炎(NCT06270225,Ⅱ期)。
BAT4706是百奥泰开发的一项经无岩藻糖基化优化的IgG1类全人源单抗候选药物,靶点为CTLA-4,用于治疗晚期实体瘤(NCT06139536,Ⅰ期)。BAT4706能特异性结合CTLA-4分子,恢复T细胞的活化,同时其增强的抗体依赖性细胞毒性作用(ADCC)能导致肿瘤微环境的Tr egs凋亡,从而提高机体对癌症的免疫反应。
BL-B01D1是由四川百利研发的一种新型EGFR/HER3双抗抗体偶联药物(ADC),载荷为新型TOP1抑制剂ED04(基于拓扑异构酶的毒性物质,属于一种喜树碱类物质)。BLB01D1的单抗部分SI-B001针对EGFR和HER3两个不同的靶点,更强的特异性增加了药物的安全性;同时通过交联作用促进两个靶点的协同内吞,提高毒素进入肿瘤细胞的效率,并进一步通过减少受体蛋白在细胞膜上的表达量来抑制肿瘤细胞生长信号,实现更好的治疗效果。新开临床试验主要适应证为食管鳞状细胞癌(NCT06304974,Ⅲ期)。
司普奇拜单抗(CM310)是由康诺亚自主研发的一种高亲和力的人源化抗体,专门针对I L-4Rα。这种抗体通过靶向IL-4Rα,双重阻断I L-4和I L-13对受体的活化,阻碍Ⅱ型炎症的信号传导途径,从而治疗与Ⅱ型炎症相关的多种疾病,如特应性皮炎、哮喘、慢性鼻窦炎伴鼻息肉以及嗜酸性食管炎等。新开临床试验主要适应证为季节性变应性鼻炎(NCT06171074,Ⅱ期)。
HLX42是复宏汉霖研发的一款靶向表皮生长因子受体(EGFR)的新型ADC候选药物,由高度特异性的人源化l gG1 EGFR抗体分子、可裂解的新型连接子-荷载毒素偶联制备而成。HLX42的荷载毒素为一种新型DNA拓扑异构酶Ⅰ(Topoisomerase Ⅰ)小分子抑制剂,通过造成DNA双链断裂,阻断DNA复制,从而导致肿瘤细胞凋亡。新开临床试验主要适应证为实体瘤(NCT06210815,Ⅰ期)。
Alnuctamab是新基医药开发的一种双特异性T细胞接合剂(TCE),以独特的2∶1方式同时结合表达b细胞成熟抗原(BCMA)的骨髓瘤细胞和T细胞(通过CD3)。这种相互作用旨在通过诱导T细胞活化和释放促炎细胞因子和细胞溶解酶来驱动骨髓瘤细胞死亡。新开临床试验主要适应证为多发性骨髓瘤(NCT06232707,Ⅲ期)。
(数据来源于美国 Clinicaltrial 数据库,标签间存在统计重复,统计时间截至2024年4月15日)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐