每周医药看点(5月20日—5月26日)
- 2024-05-28 09:46
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 《中国新药注册临床试验进展年度报告(2023年)》发布;国家药监局发布第八十批仿制药参比制剂目录;国家医保局发文要求进一步推广三明医改经验……5月20日—5月26日,医药行业的这些动态值得关注。
行业政策动态
1.国家药监局、国家卫生健康委发布《关于加强右美沙芬等药品管理的通知》(以下简称《通知》),根据相关法律法规,结合精神药品目录调整和药品上市等情况,明确相关药品生产、标签、说明书变更以及经营企业原有库存产品处理等相应要求。《通知》明确,生产右美沙芬、咪达唑仑原料药和注射剂、含地芬诺酯复方制剂的药品生产企业应当按照《麻醉药品和精神药品管理条例》《关于印发〈麻醉药品和精神药品生产管理办法(试行)〉的通知》有关规定,向所在地省级药品监督管理部门申请相应品种的定点生产资格。生产右美沙芬、咪达唑仑注射液的药品生产企业应当申报2024年度生产需用计划。
2.国家药监局发布公告,众生片和强肾片由处方药转换为非处方药。品种名单及非处方药说明书范本一并发布。
3.国家药监局发布仿制药参比制剂目录(第八十批),涉及甲苯磺酸尼拉帕利胶囊等品种。
4.国家医保局发布《关于进一步推广三明医改经验 持续推动医保工作创新发展的通知》,要求进一步推广三明医改经验,持续巩固落实三明医改制度性成果。在医保支付改革方面,在确保2024年实现按病组和病种分值(DRG/DIP)支付方式改革统筹地区全覆盖的基础上,着力巩固做实、提质增效。规范病组(病种)、权重(分值)等核心要素管理和调整机制,建立与医疗机构的意见收集和反馈机制,加强沟通协商,推动医保、医疗“相向而行”。
5.国家医保局办公室发布《关于加强区域协同 做好2024年医药集中采购提质扩面的通知》(以下简称《通知》)。《通知》要求,扩大联盟范围,要形成全国联盟集中采购。各省际联盟要进一步加强跟全国面上协调,条件具备的提升为全国性联盟采购,牵头省份应与国家医保局沟通协调,并邀请所有省份参加,形成全国联盟集中采购,各省份原则上均应参与全国联采。聚焦重点领域,到2024年底,全国各省份至少完成1批药品和1批医用耗材集采,且实现国家和省级集采(含参与联盟采购)药品数累计达到500个以上。
6.国家药监局药品审评中心(CDE)发布《中国新药注册临床试验进展年度报告(2023年)》(以下简称《报告》)。《报告》显示,2023年,药物临床试验登记与信息公示平台登记临床试验总量首次突破4000项,临床试验实施效率进一步改善,启动效率进一步提高。从《报告》来看,1类创新药试验占新药临床试验登记总量的69.1%。1类创新药总体仍处于研发早期阶段,但与2022年度相比,Ⅱ、Ⅲ期临床试验占比均出现小幅增加。通过《报告》,也能感受到鼓励研发政策所带来的积极影响:儿童人群、罕见疾病患者等特定人群用药的临床试验数量呈现显著增长趋势,医学影像学和放射性药物临床试验保持小幅增加。研发企业在细胞治疗、基因治疗等新技术领域加强布局,2023年登记细胞和基因治疗产品类临床试验81项,较2022年增长近1倍。
7.CDE发布《以患者为中心的罕见疾病药物研发试点工作计划(“关爱计划”)》以及该试点工作计划配套的申报指南、实施框架的征求意见稿。征求意见时限为自发布之日起1个月。“关爱计划”是一项在罕见疾病药物研发领域落实“以患者为中心”理念的试点工作,旨在指导和帮助研发单位在药物研发全程充分倾听患者声音,提升“将患者体验数据整合入罕见疾病药物临床研发”的科学性、规范性及合理性,并在此过程中增强监管机构、药物研发单位和患者等专注于罕见疾病药物研发的各方沟通与协作,进而高质高效推动罕见病药物研发和上市,满足迫切的临床需求。
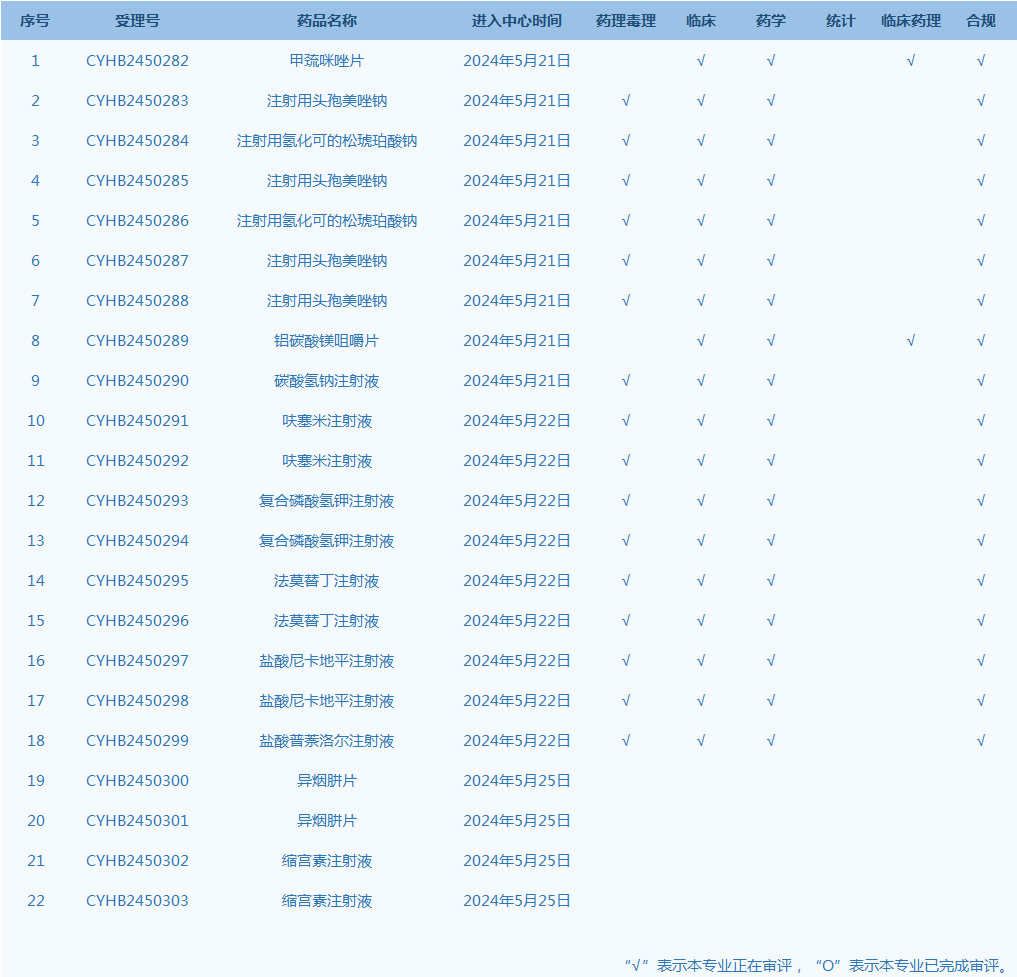
8.CDE网站公示22个仿制药一致性评价任务,涉及甲巯咪唑片等品种(截至5月26日)。
产品研发上市信息
1.国家药监局通过优先审评审批程序批准康方赛诺医药有限公司申报的依沃西单抗注射液(商品名:依达方)上市。本品联合培美曲塞和卡铂,用于经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗后进展的EGFR基因突变阳性的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)患者的治疗。
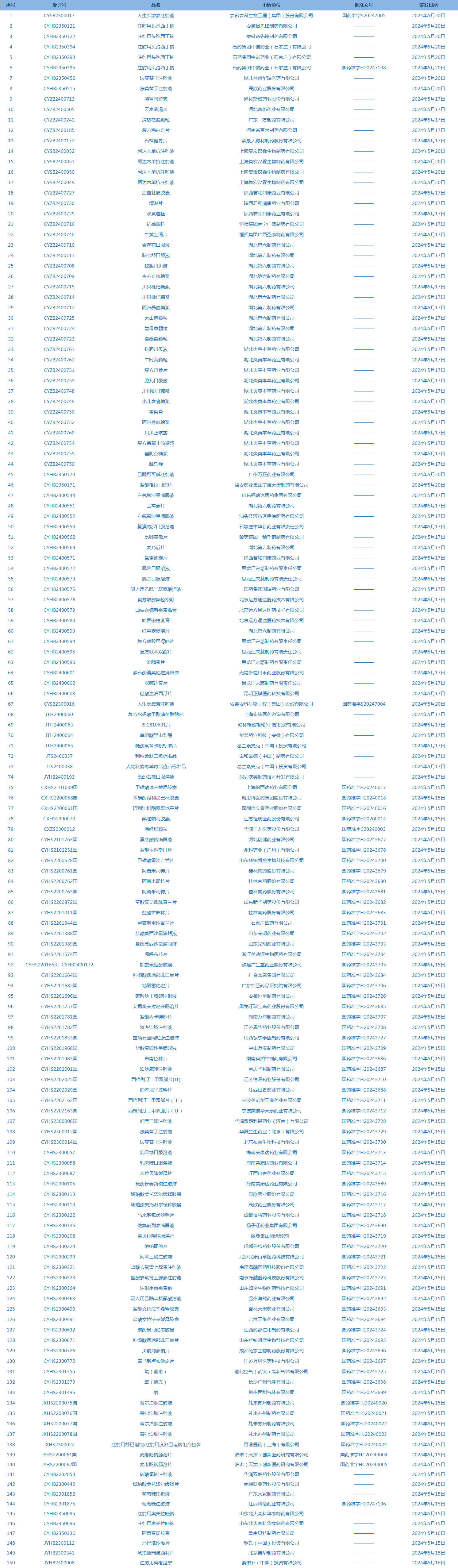
2.国家药监局发布4期药品批准证明文件送达信息,共包括150个受理号,涉及安徽安科生物工程(集团)股份有限公司等企业(截至5月26日)。
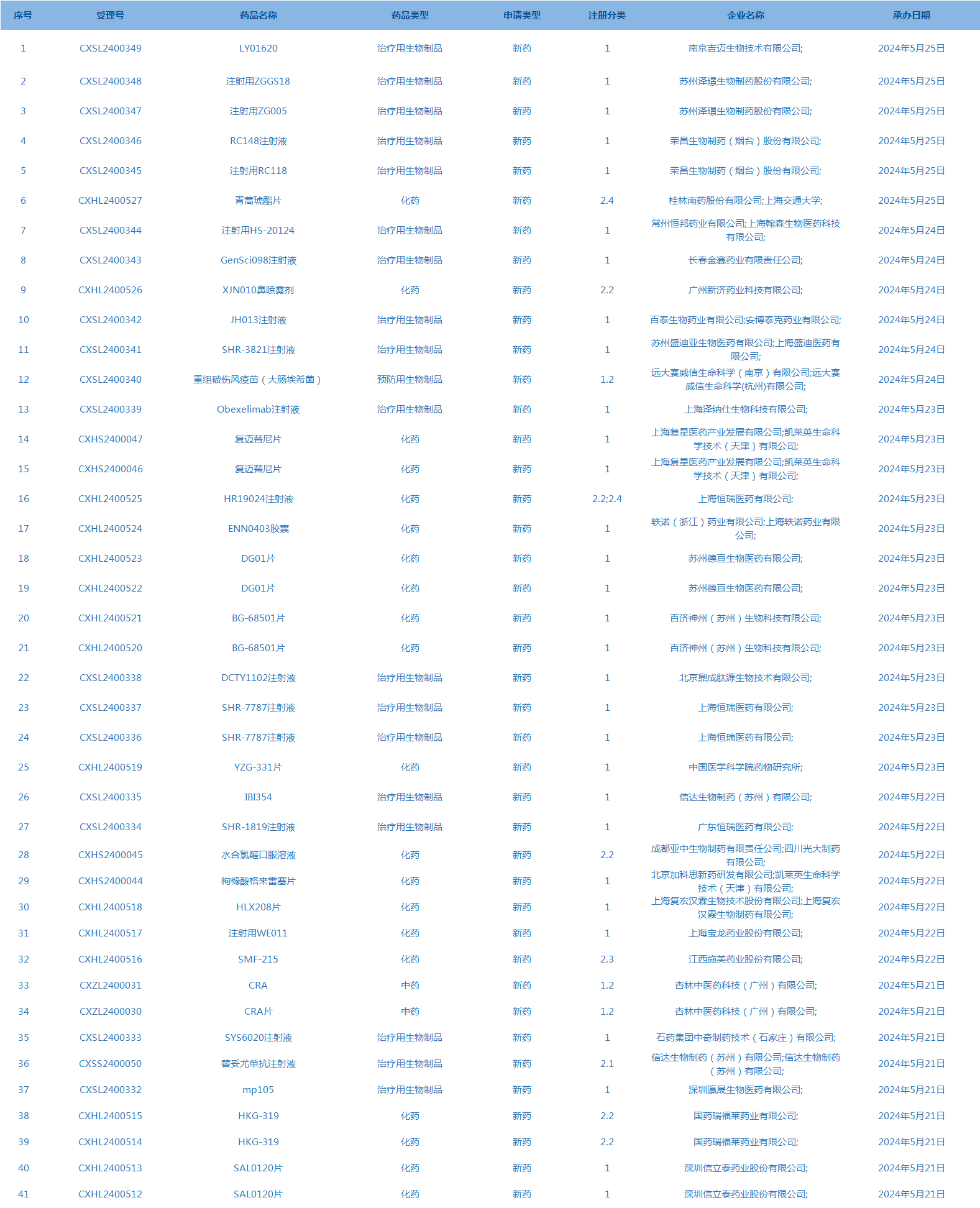
3.CDE承办受理41个新药上市申请,包括LY01620等药品(截至5月26日)。
4.中美瑞康宣布,其自主研发的小激活RNA(saRNA)药物RAG-01获得美国食品药品管理局(FDA)授予快速通道资格,用于治疗卡介苗无应答的非肌层浸润性膀胱癌。
医药企业观察
1.达歌生物宣布与武田达成多靶点合作研发及独家许可协议,以发现和开发用于肿瘤学、神经科学和炎症领域多个靶点的新型分子胶降解剂。根据协议,达歌生物将利用其GlueXplorer平台,针对武田选定的特定疾病靶点发现、验证和优化分子胶降解剂。在达到一定进展阶段后,这些项目将移交给武田进行进一步开发和商业化。达歌生物将获得首付款和潜在里程碑共计最高可达12亿美元。同时,武田也会对达歌生物进行股权投资。
2.翰宇药业发布公告称,公司与中关村科学城管理委员会签署了《支持深圳翰宇药业股份有限公司驻区发展协议》,双方将在多肽药物开发领域开展深入合作,共同推动北京市海淀区在医药健康产业的壮大,支持深圳翰宇药业股份有限公司在北京市海淀区落地北方总部,助力企业发展成为医药健康领域的领先企业。
3.5月24日,盛禾生物在港交所上市。据悉,盛禾生物成立于2018年,是一家临床阶段生物医药公司,专注于发现、开发和商业化用于治疗癌症和自身免疫性疾病的生物制剂。该公司研发管线中包括了9种创新产品,涵盖单抗、双抗和抗体细胞因子药物等,进展最快的产品已经进入Ⅱ/Ⅲ期临床研究阶段。
4.炎明生物宣布完成数亿元人民币的A+轮融资。本轮融资资金将用于支持该公司ALPK1小分子激动剂PTT-936的临床研究,以及其他先天免疫抑制剂及细胞焦亡抑制剂项目的临床推进,并拓展研发管线。
药品集中采购
1.北京市医保局发布《关于执行2023年京津冀药品带量采购和2021年京津冀第二批带量联动药品协议期满接续中选结果有关工作的通知》。通知明确,本次集采中选药品形成的供应清单产品实行统一挂网、统一调价、带量采购。医疗机构使用数字证书登录北京市医保信息平台药品和医用耗材招采管理子系统查询中选药品供应清单、中选价格及约定采购量等。其他属于带量采购范围内价格适宜的非中选药品,可作为中选药品的补充进行采购销售。
2.河北省医用药品器械集中采购中心发布《关于公布国谈及国谈同通用名和竞价药品挂网的通知》,将符合挂网条件的国谈同通用名药品进行公布,共包括14个药品。企业在外省出现挂网价低于我省挂网价的,应于30日内提出价格调整申请,否则从查实之日起暂停一年挂网资格。(刘思慧整理)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐













