2024年5月中美欧批准上市新药盘点——四款“全球新”药物在我国获批上市
- 2024-06-20 16:11
- 作者:陈倩
- 来源:中国医药报
今年5月份中美欧批准上市的新药中,中国批准上市新药数量最多,四款新药为全球范围内首次获批的新药。
中国上市七款新药
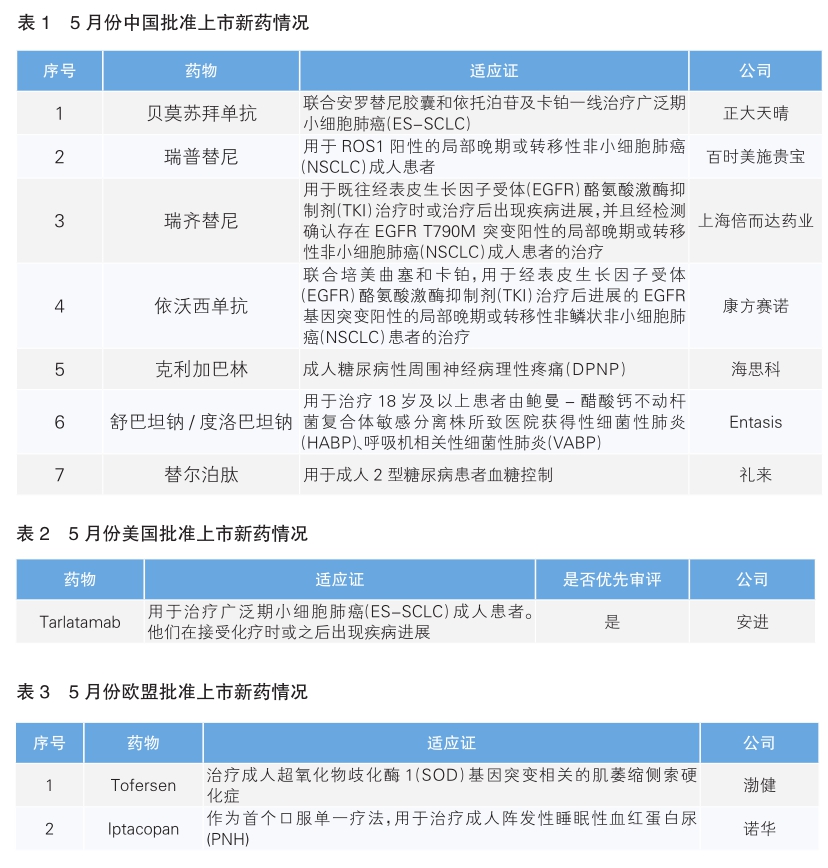
5月份,我国批准了7款新药上市。根据Pharmadigger数据库,贝莫苏拜单抗、瑞齐替尼、依沃西单抗和克利加巴林为当月全球范围内首次获批的新药。(详见表1)
贝莫苏拜单抗(商品名:安柏尼)是正大天晴研发的一款靶向PD-L1的新型全人源化IgG1抗体,可阻止PD-L1与T细胞表面的PD-1和B7.1受体结合,使T细胞恢复活性,从而增强免疫应答。小细胞肺癌是一种极具侵袭性的恶性肿瘤,呈现转移早、扩散快等特征,因此大部分患者在就诊时就已达广泛期,5年生存率不足10%。该药本次获批是基于名为ETER701的Ⅲ期临床研究数据,结果显示,试验药组(贝莫苏拜单抗+安罗替尼+依托泊苷+卡铂的四药联合组)患者中位生存期为19.3个月,比对照组(安慰剂+化疗)显著延长达7.4个月,死亡风险降低39%;试验药中位无进展生存期为6.9个月,比对照组显著延长达2.7个月,疾病进展/死亡风险降低68%。
瑞普替尼(Repotrectinib,商品名:奥凯乐)是百时美施贵宝研发的一款ROS1和NTRK靶向抑制剂。携带ROS1和NTRK基因融合的肿瘤患者在接受目前已获批准的靶向疗法后,通常会出现耐药突变,这些突变限制了药物与靶点的结合,最终导致肿瘤进展。2020年7月,再鼎医药与Turning Point公司达成一项超1.7亿美元的合作,获得瑞普替尼在大中华区的独家开发及商业化权益,而后Turning Point于2022年6月被百时美施贵宝收购。该药本次获批主要基于名为TRIDENT-1的Ⅰ/Ⅱ期临床研究数据,结果显示,在TKI(酪氨酸激酶抑制剂)初治的非小细胞肺癌(NSCLC)患者中有约80%获得肿瘤应答;在既往接受过一种ROS1TKI治疗且既往未接受化疗的患者中,有约40%的患者获得肿瘤应答。TRIDENT-1研究的中国亚组患者获益类似。瑞普替尼此前于2023年11月在美国获批上市。
瑞齐替尼(商品名:瑞必达)是上海倍而达药业研发的一款不可逆、高选择性的第三代小分子表皮生长因子受体(EGFR)激酶抑制剂,对EGFR突变体(如EGFR T790M、L858R)具有不可逆抑制作用。2022年9月,倍而达药业在欧洲肿瘤内科学会(ESMO)上公布了一项瑞齐替尼一线治疗EGFR T790突变NSCLC患者的Ⅱ期临床试验数据。该试验共纳入43例患者,结果显示,约有85%的患者获得肿瘤应答,中位生存约为25个月。2021年3月,石药集团与倍而达药业达成协议,获得瑞齐替尼在中国的商业化权益。
依沃西单抗(商品名:依达方)是康方赛诺研发的一种靶向结合人血管内皮生长因子-A(VEGF-A)和PD-1的IgG1亚型人源化双特异性抗体,可同时与VEGF-A、PD-1结合,竞争性阻断VEGF-A、PD-1与其配体的相互作用,发挥抗肿瘤活性。与联合疗法相比,依沃西单抗作为单一药物同时阻断这两个靶点,可能会更有效地阻断这两个通路,从而增强抗肿瘤活性。该药本次获批基于依沃西联合化疗一线治疗晚期NSCLC的Ⅱ期临床研究,在治疗EGFR-TKI进展的EGFR突变的晚期非鳞NSCLC患者的队列中,中位随访时间为25.8个月时,肿瘤客观缓解率为68.4%,疾病控制率为94.7%。
克利加巴林(商品名:思美宁)是海思科医药研发的一款无需滴定的口服第三代中枢神经系统钙离子通道调节剂。作为抑制性神经递质γ-氨基丁酸(GABA)的结构衍生物,可与中枢神经系统中电压敏感型钙离子通道α2δ受体结合,减少中枢神经系统电压依赖性钙通道的钙离子内流,从而减少谷氨酸盐、去甲肾上腺素和P物质等兴奋性神经递质的释放,具有镇痛、抗癫痫和抗焦虑的活性。该药本次获批主要基于在治疗中国成人糖尿病性周围神经病理性疼痛(DPNP)人群的Ⅱ/Ⅲ期临床研究,与安慰剂相比,经克利加巴林治疗的DPNP患者从第1周起疼痛减轻。治疗13周,在40mg/d和80mg/d两个剂量下,其能够显著降低患者的每日疼痛评分。
注射用舒巴坦钠/注射用度洛巴坦钠组合包装(商品名:鼎优乐)是Entasis公司开发的一款静脉输注的研究型新药,是由舒巴坦(一种静脉输注的β-内酰胺类抗生素)和度洛巴坦钠(一种新型广谱静脉输注的β-内酰胺酶抑制剂,或称BLI)组合而成。该药本次获批基于名为ATTACK的Ⅲ期临床研究,结果显示,舒巴坦钠-度洛巴坦钠可有效治疗碳青霉烯类耐药鲍曼不动杆菌-醋酸钙不动杆菌复合体引起的严重感染,且安全性良好。再鼎医药拥有在大中华区、东南亚、日韩和澳新地区的独家授权。鼎优乐已于2023年5月在美国获批上市。
替尔泊肽(Tirzepatide,商品名:穆峰达)是礼来研发的一款葡萄糖依赖性促胰岛素多肽(GIP)/ 胰高糖素样肽-1(GLP-1)受体激动剂,能够选择性结合并激动GIP受体和 GLP-1受体两种天然肠促胰素受体,每周注射一次。该药本次获批主要基于Ⅲ期临床试验SURPASS 1-5及亚太地区关键Ⅲ期临床试验 SURPASS-APCombo。结果显示,与对照组相比,不同剂量的替尔泊肽均实现糖化血红蛋白和体重的显著降低。替尔泊肽此前已于2022年5月在美国获批上市。
美国上市一款新药
5月份,美国批准1款新药上市。根据Pharmadigger数据库,该药为全球范围内首次获批的新药。(详见表2)
Tarlatamab(商品名:Imdelltra)由安进制药研发,是目前首个也是唯一一款获批用于治疗侵袭性肺癌的DLL3靶向双特异性T细胞接合剂疗法,可同时结合T细胞上的CD3和人小细胞肺癌细胞上的DLL3。DLL3在约85%的小细胞肺癌(SCLC)和大细胞神经内分泌癌患者的肿瘤细胞表面表达,另外还在多形性胶质母细胞瘤、黑色素瘤、胰腺癌和直肠癌等癌细胞中高表达,但在健康组织中表达较少。本次Tarlatamab的获批是基于Ⅱ期临床试验DeLLphi-301的研究结果。结果显示,Tarlatamab在含铂化疗期间或之后疾病进展的晚期SCLC患者中,发表的数据显示中位随访时间为10.6个月时;接受10mg剂量组的患者客观缓解率为40%,中位无进展生存期约为5个月。
欧盟上市两款新药
5月份,欧盟批准了2款新药上市。根据Pharmadigger数据库,它们均非全球首次批准的新药。(详见表3)
Tofersen(商品名:Qalsody)由渤健和Ionis共同开发,是全球首款靶向治疗成人SOD1基因突变型肌萎缩侧索硬化症(SOD1-ALS)的反义寡核苷酸药物。该药本次获批主要基于为期28周的Ⅲ期临床试验VALOR结果。结果显示,与安慰剂组相比,接受Tofersen的受试者血浆神经丝轻链减少了60%,表明神经元损伤减少。Tofersen此前已于2023年4月在美国获批上市。
Iptacopan(商品名:Fabhalta)是诺华研发的首个靶向补体旁路途径B因子的口服抑制剂。该药本次获批基于Ⅲ期临床试验APPLYPNH结果。该试验针对先前接受过抗C5药物治疗但仍患有贫血(血红蛋白<10g/dL)的阵发性睡眠性血红蛋白尿(PNH)患者,患者转而使用Iptacopan。试验证明,在不输注红细胞的情况下,Iptacopan在改善血红蛋白方面具有优势。该药此前于2023年12月在美国获批上市。(陈倩)
(注:本文中的新药分别按中国、美国、欧盟三地新分子实体或生物药首次NDA/BLA来统计,一些药物首先在美国上市后首次在中国或欧盟上市时也会纳入统计)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐