【聚焦药品追溯体系建设之二】 欧盟药品追溯系统建设现状
- 2017-06-13 18:03
- 作者:沙梅 何健民
- 来源:中国医药报
发展历程
2006年2月,欧洲制药工业协会联合会(EFPIA)联合药品供应链中各利益相关集团,着手建立一套在欧洲范围内通行的药品电子监管系统,即欧洲药品验证系统(EMVS)。
基于成本-效益最大化的理念,EMVS选择国际通用的二维矩阵码作为其信息载体,采用“配药点验证”的运行方法,由药品供应系统中的各利益相关者共同管理(如图1)。
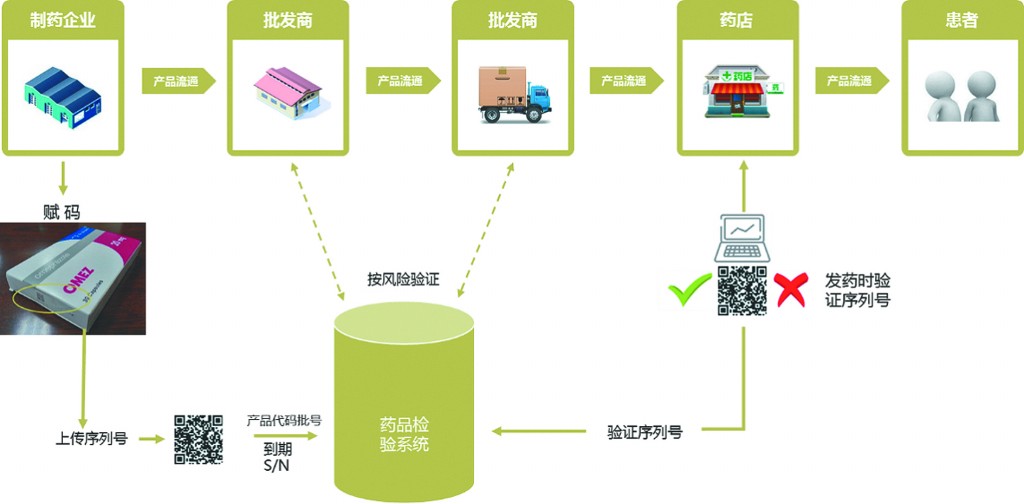
图1 欧盟处方药跟踪与追溯系统运行图
2008年9月,欧盟成立了专门的EMVS系统指导委员会。该委员会由EFPIA、欧洲药房联盟(PGEU)和欧洲药品批发企业联盟(GIRP)作为正式成员,欧洲仿制药商联盟(EGA)作为观察员,4个机构共同组成。各机构分别代表原研药商、药房、药品批发企业和仿制药商的利益,共同对EMVS的推行事宜进行指导和决策。
相对均衡的机构设置,有效平衡了各大集团的利益,有利于药品电子监管制度的积极推行。此外,在EMVS系统指导委员会的指导和协助下,欧盟还将建立欧洲药品验证组织(EMVO)。该组织的主要任务是建立和管理欧洲药品编码中心。欧洲药品编码中心是药品生产商和平行进口商的数据传输门户,欧盟境内所有药品生产商和平行进口商统一通过该中心上传或验证药品信息,其下接若干国家系统或国家蓝图系统(见图2)。
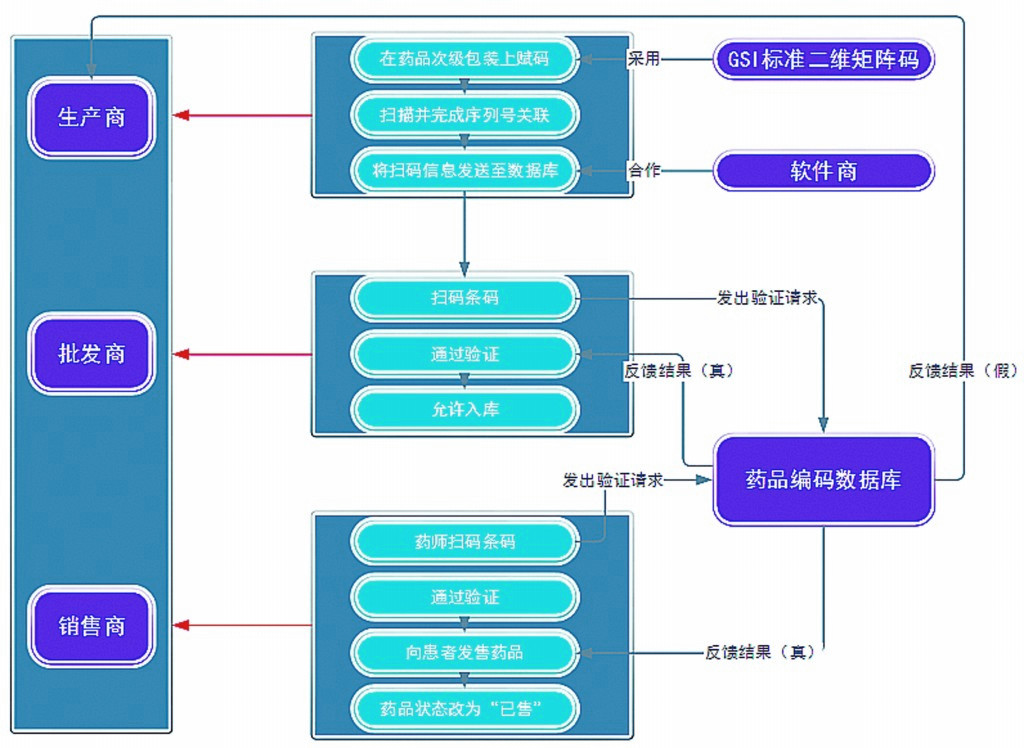
图2 欧洲药品电子监管系统执行机构
2011年7月,欧洲议会和欧盟理事会通过了《欧盟假药指令》,明确要求为欧盟境内流通的每一份药品建立“可供验证其真实性”的安全档案,并建立一个欧盟国家通行的数据库,储存药品安全信息。该法案的颁布为欧洲药品电子监管系统的实施奠定了法律基础。
欧洲药品电子监管系统利用“二维矩阵码”对单件药品进行赋码,采用“配药点验证”模式,通过强制实行发药前监管码信息验证,以实现对药品的安全监管及流向追溯。经过多年运行,该模式在欧洲各国受到广泛认可,目前在各国已基本实现全面覆盖。
原理和应用
药品生产商必须在药品出厂前将储存药品信息的二维矩阵码印在每盒药品的次级包装上,即与药物直接接触的包装组件上。根据《欧洲药品包装编码指南》,二维矩阵码编码结构必须符合GS1标准,并包含下列药品信息:该药品的全球贸易项目代码(GTIN)、药品序列号、药品过期日和药品批次。其中,药品序列号是电子监管系统识别药品的重要标识,要求互不重复。此外,为防止造假者按规律推算药品序列号,其生成过程完全随机,且须在药品超过保质期7年后,其序列号才能被重复使用。赋码完成后,生产商需要通过扫描条码,完成药品与序列号的相互关联,并将编码信息发送至欧洲药品编码中心数据库。
药品供应链中的其他参与者(如批发商)在取得系统认可后,可自愿在任何时候通过扫描药品包装上的二维矩阵码发出验证请求,以确认药品信息。另外,EMVS指导委员会计划在EMVS系统运行的第二阶段,由药品分销商通过已有数据交换网络添加相关信息,进而建立药品全程追踪系统。
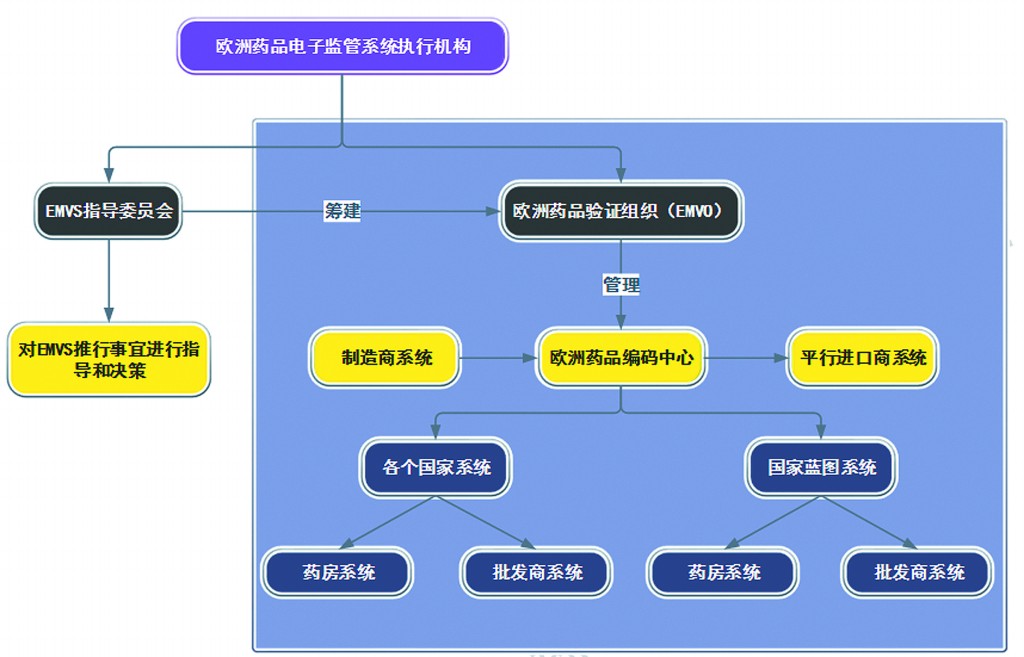
图3 欧洲药品验证系统运行模式示意图
以医院药房和零售药店为主的药品销售商在追溯系统中扮演着十分重要的角色。根据《欧洲药品验证系统实施阶段信息传输要求》,药剂师在发售药品前,须先扫描药品包装上的二维矩阵码。扫描完成后,系统会将检测到的药品信息与中心数据库中的信息进行对比。如果扫描到矩阵码中的信息与数据库中的信息相符,并且满足其他标准(如“药品在保质期内”和“药品不在召回范围内”),药剂师可将药品发售给患者,此数据库中的药品状态自动改为“已发售”。如果扫描到矩阵码中的信息与数据库中的信息不相符(如显示“数据库中不存在该序列号”),或者该序列号所代表的药品状态为“已发售”,则说明该药品有可能是假药。这时,药剂师应拒绝将该药品发售给患者。此后,系统会自动向该药品的制造商发出假药警报。欧洲药品验证系统运行模式如图3所示。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐
-
第26期“安安有约——食药科普大讲堂” 美丽520:破解化妆品谣言正当时
5月20日,坊间颇具浪漫色彩的一天,广东省药品监督管理局主办的第26期“安安有约——食药科普大讲堂活动”在广州举行,化妆品专家蒋丽刚《破解化妆品谣言》的专题讲座也如期开讲。 2019-05-27 09:55 -
42a0b751-7d56-4b1c-a143-a99f7da2fa3c_260x150c.jpg)
科普大讲堂
2019-04-28 15:07
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有









