审评审批改革提速 产业创新步伐加快——《2017年度医疗器械注册工作报告》解析
- 2018-04-03 14:43
- 作者:陈燕飞
- 来源:中国健康传媒集团-中国医药报
中国医药报记者 陈燕飞 报道 3月28日,《2017年度医疗器械注册工作报告》(以下简称《报告》)发布,用翔实的内容和数据,全面展示和分析了2017年我国医疗器械注册管理工作进展情况。《报告》显示,2017年,我国医疗器械注册管理法规体系不断完善,医疗器械审评审批制度改革深入推进,境内医疗器械注册增长明显,产业自主创新意识增强。
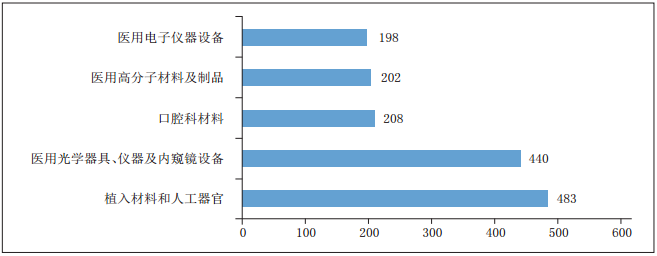
表为境内第三类医疗器械注册品种排位图
法规标准逐步完善
2017年,国家医疗器械监管部门配合完成《医疗器械监督管理条例》修正案,发布了《医疗器械标准管理办法》《体外诊断试剂注册管理办法修正案》《医疗器械临床试验机构条件和备案管理办法》等法规文件。
《报告》就此指出,医疗器械注册管理法规体系的逐步完善,为我国的医疗器械注册管理工作提供了制度保障;同时也为医疗器械企业注册申报工作的有序开展提供了良好的法规基础。
医疗器械标准是医疗器械研制、生产、经营、使用和监督管理遵循的统一技术要求,是医疗器械产业发展水平的重要标志。2017年,国家医疗器械监管部门修订发布《医疗器械标准制修订工作管理规范》,细化了标准制修订工作程序;组织开展86项医疗器械行业标准制修订工作,审核发布《医疗器械质量管理体系用于法规的要求》等98项医疗器械行业标准。
科学合理的医疗器械分类是医疗器械全过程监管的重要基础。2017年,国家医疗器械监管部门组织成立了医疗器械分类技术委员会,发布了新《医疗器械分类目录》,并积极开展了宣贯、培训工作;完成过敏原类、流式细胞仪配套用、免疫组化和原位杂交类体外诊断试剂产品的属性及类别调整工作,合理降低有关产品类别,满足临床使用需求。
产品创新步伐加快
2017年,国家医疗器械监管部门全力推进医疗器械审评审批制度改革工作。特别是去年10月,中办、国办《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(以下简称《意见》)发布后,改革步伐进一步加快。
在完善审评机制,优化审评流程方面,先后发布了《医疗器械审评沟通交流管理办法(试行)》《关于发布医疗器械技术审评专家咨询委员会管理办法的公告》《关于调整部分医疗器械行政审批事项审批程序的决定》;发布第三批免于进行临床试验医疗器械目录,对164种医疗器械豁免临床试验,减轻了行政相对人负担。
在《意见》激励下,国内医疗器械创新产品注册申请呈风起云涌之势。2017年,国家医疗器械监管部门共收到创新医疗器械特别审批申请273项,最终批准12个创新产品注册上市,比2016年增加了2个产品。此外,还批准辽宁垠艺生物科技股份有限公司生产的药物洗脱球囊导管、武汉华大智造科技有限公司生产的基因测序仪、无锡市申瑞生物制品有限公司生产的尿中游离巯基检测试剂盒(生化法)等部分有较好临床应用前景的医疗器械产品注册。
境内器械注册增长明显
医疗器械临床试验是保证器械产品安全性和有效性的重要举措。《报告》显示,2017年医疗器械临床试验监督抽查力度不断加大,全年组织2批医疗器械临床试验监督检查,共抽取19家企业的19个注册申请项目,对涉及的38家临床试验机构进行检查,对3个存在真实性问题的注册申请作出不予注册、自不予注册之日起1年内不予再次受理的处理决定,有力地净化了医疗器械临床试验环境。其间,共有169家企业主动撤回261项医疗器械注册申请。
此外,针对国内医疗器械发展实际,国家医疗器械监管部门还发布实施了《医疗器械网络安全注册技术审查指导原则》《移动医疗器械注册技术审查指导原则》《医疗器械注册单元划分指导原则》,并发布了人工耳蜗植入系统、医用磁共振成像系统、髋关节假体系统等80项医疗器械注册技术审查指导原则,有效统一了相关审查要求,对规范指导相关产业健康发展意义重大。
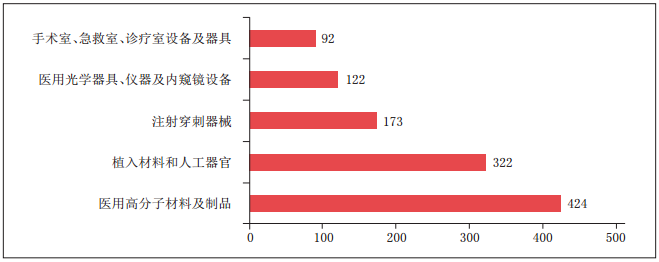
表为进口医疗器械注册品种排位图
临床试验和审查要求的不断规范,助推了境内器械的发展壮大。从《报告》中的数据可以看出,与2016年相比,2017年批准的境内第二类、第三类医疗器械注册数量均有明显增长。其中,批准境内第三类医疗器械注册3300项(医疗器械1910项,体外诊断试剂1390项),比2016年增加了13.7%;批准进口医疗器械5623项(进口第二类医疗器械注册2823项,进口第三类医疗器械注册2800项),同比减少2.3%。值得关注的是,在批准注册的境内第三类医疗器械中,注册数量排在首位的医用高分子材料及制品,其注册数量与2016年相比,增长高达56.5%。
与此同时,境内第二类医疗器械注册数量也在显著增长。去年各省级食品药品监管部门共批准境内第二类医疗器械注册18582项,比2016年增长了19.5%。
延伸阅读:
2017年获批创新医疗器械一览
2017年,国家医疗器械监管部门共批准12个创新医疗器械产品上市,这些创新产品的核心技术均具有我国发明专利权或发明专利申请已经国务院专利行政部门公开,其产品主要工作原理/作用机理为国内首创,具有显著的临床应用价值。
1.分支型主动脉覆膜支架及输送系统(国械注准20173463241):上海微创医疗器械(集团)有限公司研发,技术属国内首创,系我国首个获批上市的分支型主动脉覆膜支架。适用于治疗胸主动脉夹层近端破口在左颈总动脉远端15毫米与左锁骨下动脉(LSA)远端20毫米之间或夹层逆撕至左锁骨下动脉的患者,为胸主动脉夹层患者提供了新的治疗方法。
2.折叠式人工玻璃体球囊(国械注准20173223296):广州卫视博生物科技有限公司研发,系我国独立研制的创新产品,属国际首创。采用医用硅橡胶材料制成,可长期填充在眼内,解决了玻璃体替代物不能长期停留在眼内、不能长期顶压视网膜或需反复手术等问题,适用于严重视网膜脱离、不能用现有玻璃体替代物进行治疗的患者。
3.经皮介入人工心脏瓣膜系统(国械注准20173460680):杭州启明医疗器械有限公司研发,系国内首个自膨式经皮介入人工心脏瓣膜。为经治疗专家团队结合评分系统评估后认为患有症状的、钙化的、重度主动脉瓣狭窄,且不适合接受常规外科手术置换瓣膜的患者带来显著临床获益。
4.一次性可吸收钉皮内吻合器(国械注准20173650874):北京颐合恒瑞医疗科技有限公司研发,技术属国内首创。适用于腹部手术皮内缝合,可在不改变医生常用缝合方式的前提下,实现闭合速度的提升,利于渗液排出,且不需拆除缝合钉,为外科手术术后缝合提供了一种新的解决方案。
5.介入人工生物心脏瓣膜(国械注准20173460698):苏州杰成医疗科技有限公司研发。可在无需心脏快速起搏的情况下自动定位植入位点,适用于经治疗专家团队结合评分系统评估后,认为不适合进行外科手术的自体主动脉瓣病变患者,为患有主动脉瓣狭窄患者和主动脉瓣关闭不全患者带来显著的临床获益。
6.左心耳封堵器系统(国械注准20173770881):先健科技(深圳)有限公司研发,系首个批准上市的国产左心耳封堵产品。主要用于卒中风险较高且长期口服抗凝治疗禁忌或抗凝治疗后仍有卒中风险的非瓣膜性房颤患者,可避免或降低左心耳内血栓脱落带来的卒中风险。
7.腹主动脉覆膜支架系统(国械注准20173461434):北京华脉泰科医疗器械有限公司研发,系首个批准上市的国产采用带倒刺裸支架设计的腹主动脉覆膜支架系统。适用于肾下腹主动脉瘤和主髂动脉瘤的腔内治疗,可增加患者的临床选择,有效降低临床治疗成本,减轻患者负担。
8.全降解鼻窦药物支架系统(国械注准20173460679):浦易(上海)生物技术有限公司研发,系境内批准的首例生物可降解鼻窦药物支架类产品。适用于慢性鼻窦炎实施功能性内窥镜鼻窦手术(FESS)患者,可防止FESS术后粘连,保持鼻腔通畅,减少炎症,有助于降低慢性鼻窦炎患者FESS术后复发率,提高患者生活质量。
9.可变角双探头单光子发射计算机断层成像设备(国械注准20173330681):北京永新医疗设备有限公司研发,系国产首台可变角、全数字化双探头临床通用型SPECT。产品加装了多针孔准直器,无需探头旋转即可实现对心脏、甲状腺等小器官快速高效精准的图像采集,适用于神经系统、心血管、肿瘤的核医学诊断。
10/11.低温冷冻手术系统(国械注准20173583088)、一次性使用无菌冷冻消融针(国械注准20173583089):海杰亚(北京)医疗器械有限公司研发。两个产品配合使用,用于临床中除空腔肿瘤外的实体肿瘤冷冻治疗,通过超低温冰球对瘤体的包围杀伤,可避免肿瘤细胞被消融针带出到正常组织上的隐患,减少出血几率。
12.植入式心脏起搏器(国械注准20173211570):先健科技(深圳)有限公司研发。适用于治疗慢性心律失常。
(本报记者 陈燕飞整理)
(责任编辑:郭思男)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐
-
第26期“安安有约——食药科普大讲堂” 美丽520:破解化妆品谣言正当时
5月20日,坊间颇具浪漫色彩的一天,广东省药品监督管理局主办的第26期“安安有约——食药科普大讲堂活动”在广州举行,化妆品专家蒋丽刚《破解化妆品谣言》的专题讲座也如期开讲。 2019-05-27 09:55 -
42a0b751-7d56-4b1c-a143-a99f7da2fa3c_260x150c.jpg)
科普大讲堂
2019-04-28 15:07
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有









