医疗器械注册审评流程之医疗器械分类
- 2020-04-07 15:17
- 作者:《图说中国医疗器械注册申报法规(中英文版)》
- 来源:中国医药报
医疗器械有多种分类方法,根据结构特征不同可分为无源医疗器械和有源医疗器械;根据是否接触人体,可分为接触人体器械和非接触人体器械。就监管来说,国家对医疗器械按照风险程度实行分类管理。医疗器械风险程度是根据医疗器械的预期目的,通过结构特征、使用形式、使用状态、是否接触人体等因素综合判定的。本文所提到的医疗器械分类主要指管理类别分类。
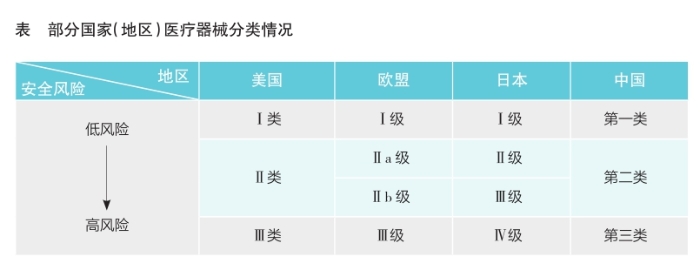
纵观发达国家对医疗器械的监管,普遍采取按照风险程度区别管理的措施,部分国家(地区)医疗器械分类情况见表。
分类规则
我国医疗器械分类釆取分类规则和分类目录合并使用的原则,医疗器械分类除应根据医疗器械分类判定表进行判定,还应遵循以下原则。
1.如果同一医疗器械适用两个或者两个以上的分类,应当采取其中风险程度最高的分类;由多个医疗器械组成的医疗器械包,其分类应当与包内风险程度最高的医疗器械一致。
2.可作为附件的医疗器械,其分类应当综合考虑该附件对配套主体医疗器械安全性、有效性的影响;如果附件对配套主体医疗器械有重要影响,附件的分类应不低于配套主体医疗器械的分类。
3.监控或者影响医疗器械主要功能的医疗器械,其分类应当与被监控或者被影响的医疗器械的分类一致。
4.以医疗器械作用为主的药械组合产品,按照第三类医疗器械管理。
5.可被人体吸收的医疗器械,按照第三类医疗器械管理。
6.对医疗效果有重要影响的有源接触人体器械,按照第三类医疗器械管理。
7.医用敷料如果有以下情形,按照第三类医疗器械管理,包括预期具有防止组织或器官粘连功能;作为人工皮肤,接触真皮深层或其以下组织受损的创面;用于慢性创面,或者可被人体全部或部分吸收。
8.以无菌形式提供的医疗器械,其分类应不低于第二类。
9.通过牵拉、撑开、扭转、压握、弯曲等作用方式,主动施加持续作用力于人体、可动态调整肢体固定位置的矫形器械(不包括仅具有固定、支撑作用的医疗器械,也不包括配合外科手术进行临时矫形的医疗器械以及外科手术后或其他治疗中进行四肢矫形的医疗器械),其分类应不低于第二类。
10.具有计量测试功能的医疗器械,其分类应不低于第二类。
11.如果医疗器械的预期目的是明确用于某种疾病的治疗,其分类应不低于第二类。
12.用于在内窥镜下完成夹取、切割组织或者取石等手术操作的无源可重复使用手术器械,按照第二类医疗器械管理。
分类目录
现行《医疗器械分类目录》(以下简称《分类目录》)按技术专业和临床使用特点分为22个子目录,子目录由一级产品类别、二级产品类别、产品描述、预期用途、品名举例和管理类别组成。22个子目录设置情况如下。
1.手术类器械设置4个子目录,分别是通用手术器械分设“01有源手术器械”和“02无源手术器械”;因分类规则中对接触神经和心血管的医疗器械有特殊要求,单独设置“03神经和心血管手术器械”;骨科手术相关医疗器械量大面广,产品种类繁杂,单独设置“04骨科手术器械”。
2.有源器械为主的医疗器械设置8个子目录,分别是“05放射治疗器械”“06医用成像器械”“07医用诊察和监护器械”“08呼吸、麻醉和急救器械”“09物理治疗器械”“10输血、透析和体外循环器械”“11医疗器械消毒灭菌器械”“12有源植入器械”。
3.无源器械为主的医疗器械设置3个子目录,分别是“13无源植入器械”“14注输、护理和防护器械”“15患者承载器械”。
4.按照临床科室划分3个子目录,分别是“16眼科器械”“17口腔科器械”“18妇产科、辅助生殖和避孕器械”。
5.“19医用康复器械”和“20中医器械”是根据《医疗器械监督管理条例》中对医用康复医疗器械和中医医疗器械两大类产品特殊管理规定而单独设置的子目录。
6.“21医用软件”是收录医用独立软件产品的子目录。
7.“22临床检验器械”子目录放置在最后,为后续体外诊断试剂修订预留空间。
《分类目录》不包括体外诊断试剂,体外诊断试剂产品类别主要按照《6840体外诊断试剂分类子目录(2013版)》进行判定。
分类查询
申请人可进入国家药品监督管理局网站进行搜索查询,或依据《医疗器械分类规则》《6840体外诊断试剂分类子目录(2013版)》等文件自行判定产品类别。
对于《分类目录》和国家药品监督管理局网站未归类的医疗器械产品,可直接按第三类医疗器械产品申报,国家药品监督管理局医疗器械技术审评中心在技术审评过程中将根据申报产品的实际情况判定类别。
申请人可通过国家药品监督管理局医疗器械标准管理中心“医疗器械分类界定信息系统”提出分类界定申请,按照分类界定程序判定的管理类别进行相应的注册申请。
属于创新、优先、药械组合的医疗器械在进入相应的审评审批工作流程后可由审评机构按照相关要求进行分类。
[本文摘编自中国医药科技出版社出版的《图说中国医疗器械注册申报法规(中英文版)》]
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘悦)
分享至
右键点击另存二维码!
-
为你推荐
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有