抗血小板药物,这些靶点正热
- 2020-05-21 17:12
- 作者:
- 来源:凯莱英
动脉血栓形成表现为心肌梗塞(MI)和缺血性中风,每年导致超过1400万人死亡,是全球致死和致残的主要原因。由于不健康生活方式的流行,动脉血栓形成导致的负担正在发展中国家快速上升,而且预计不久的将来会在全球范围大幅增长。另外,动脉血栓形成造成的经济负担对于医疗保健支出和生产力损失也有重大影响。应对这一挑战需要多方面的干预措施,包括开发新的治疗手段。由于血小板在介导动脉粥样硬化血栓形成中的重要作用,抗血小板药物是预防和治疗动脉血栓形成的核心。
已上市抗血小板药物
根据抗血小板药物的作用靶点,已上市的抗血小板药物包括环氧化酶(COX)抑制剂、P2Y12嘌呤受体拮抗剂、血小板膜糖蛋白IIb/IIIa(GPIIb/IIIa)受体拮抗剂和蛋白酶激活受体1(PAR-1)拮抗剂(图1)。
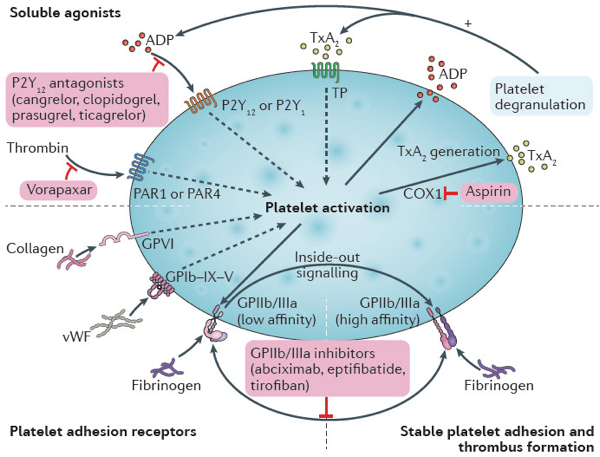
图1.抗血小板药物靶点
环氧化酶(COX)抑制剂
阿司匹林是最早的抗血小板药物,在十九世纪末被合成,其抗血小板作用及分子机制分别在20世纪60年代和70年代被发现。阿司匹林通过对COX1的不可逆抑制来阻断血栓素A2(TxA2)的产生,从而抑制TxA2诱导的血小板活化和聚集。
P2Y12嘌呤受体拮抗剂
P2Y12受体在介导ADP刺激的GPIIb/IIIa持续活化中具有重要作用,而GPIIb/IIIa是介导血小板黏附的主要受体。P2Y12受体拮抗剂可以抑制由ADP诱导的血小板活化扩增,产生有效的抗血栓形成作用。
表1.已上市P2Y12受体拮抗剂
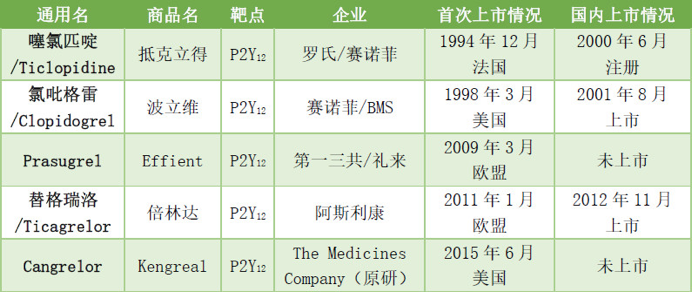
P2Y12抑制剂包括两类药物:噻吩并吡啶类(噻氯匹定、氯吡格雷和Prasugrel)和ATP类似物(替格瑞洛和Cangrelor)(表1)。噻吩并吡啶类药物基本是口服前药,需通过血浆酯酶或肝细胞色素P450(CYP450)转化为不可逆地抑制P2Y12受体的活性代谢物。ATP类似物是直接作用于P2Y12受体的抑制剂,不需要CYP450的活化。
氯吡格雷是重要的抗血小板药物之一,上市不久即成为重磅产品,2012年核心专利到期后销售额依然可观(图2)。而替格瑞洛是氯吡格雷的主要竞争对手,已有研究显示替格瑞洛的疗效优于氯吡格雷,它也被多部治疗指南推荐用于治疗急性冠脉综合征,且2017年通过医保谈判纳入全国医保乙类。
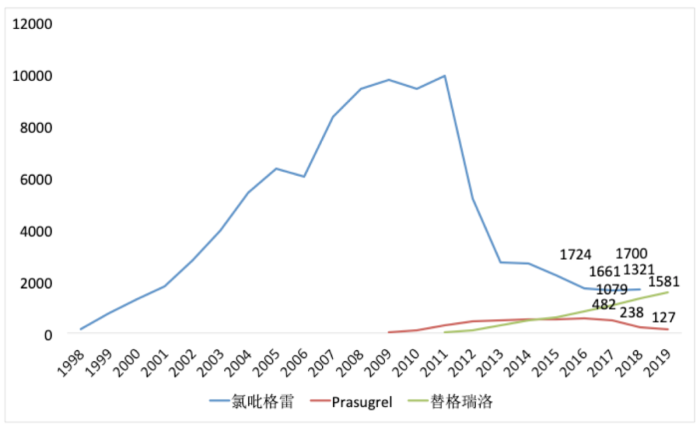
图2.已上市P2Y12受体拮抗剂销售额(USDM)
血小板膜糖蛋白IIb/IIIa(GPIIb/IIIa)受体拮抗剂
GPIIb/IIIa拮抗剂是配体模拟分子,其阻止纤维蛋白原与活化的血小板结合,从而直接抑制血小板聚集。目前上市的有三种药物:替罗非班,一种非肽类小分子,可以模拟纤维蛋白原结合位点;依替巴肽,一种环状七肽,具有赖氨酸-甘氨酸-天冬氨酸(KGD)序列,也可以模拟GPIIb/IIIa内的纤维蛋白原结合序列;以及阿昔单抗,一种鼠源单克隆抗体的人源化抗原结合片段。(表2)
表2.已上市GPIIb/IIIa拮抗剂
GPIIb/IIIa与纤维蛋白原的结合是血小板聚集的最终共同途径,这说明对GPIIb/IIIa的抑制是阻断血小板聚集的最有效方法。然而,除高风险患者外,GPIIb/IIIa拮抗剂的临床应用逐渐减少,这与P2Y12受体拮抗剂的使用增加形成巨大反差(图3)。
与P2Y12受体拮抗剂相比,GPIIb/IIIa抑制剂的主要问题与其结合特性有关。另外,已批准和最初开发的GPIIb/IIIa拮抗剂只能通过静脉内给药。虽然几家公司开发了口服剂型作为潜在的一级和二级预防疗法,但心血管疾病死亡率增加等负面临床结果基本上终止了GPIIb/IIIa拮抗剂的预防潜力,并严重影响了这类药物的开发计划。尽管如此,为了能发现具有强抗血小板活性、高口服生物利用度和较低出血风险的新型GPIIb/IIIa拮抗剂,仍有大量研究工作在进行。
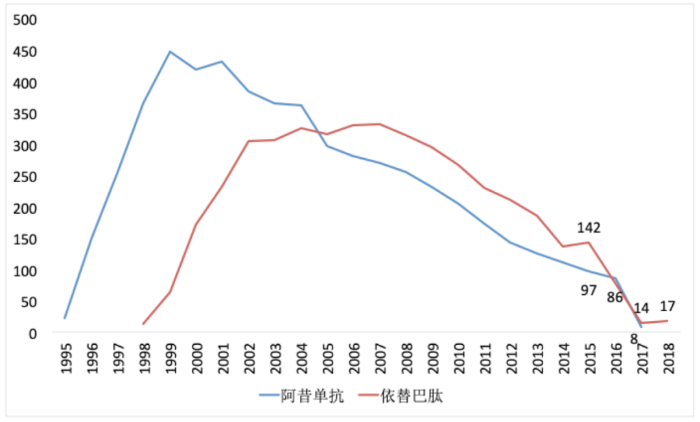
图3.已上市GPIIb/IIIa拮抗剂销售额(USDM)
蛋白酶激活受体1(PAR-1)拮抗剂
蛋白酶激活受体(PARs)是特异性血小板表面受体,在由凝血酶激动剂活化的凝血酶诱导内部信号传导通路中具有重要作用。目前已发现四种PARs,包括PAR-1、PAR-2、PAR-3和PAR-4。其中,PAR-1、PAR-3和PAR-4被凝血酶激活,而PAR-2由胰蛋白酶激活。PAR-1是人、猴和豚鼠血小板上主要的凝血酶激活受体,这表明它是很有潜力的抗血小板和抗血栓治疗靶点。PAR-1拮抗剂抑制凝血酶介导的血小板活化,而不影响凝血酶在凝血过程中的作用。目前只有一款PAR-1拮抗剂上市,即默沙东的vorapaxar,它于2014年被FDA批准作为心血管疾病患者的抗血小板药物。
创新在研靶点
为改善现有靶点药物在临床治疗中的不足,研发人员除了尝试对这些药物升级迭代外,也在探索多个新型靶点,包括GPIb-vWF轴、PI3Kβ、PAR-4、TxA2前列腺素受体、前列腺素EP3受体、P2Y1、GPVI胶原蛋白受体等。
GPIb-vWF轴抑制剂
血小板的GPIb-IX-V复合物可以在血管损伤部位通过其GPIb亚基与血管性血友病因子(vWF)结合,而且GPIb和vWF之间的相互作用在狭窄动脉等高剪切应力情况下会加强。目前有多种GPIb-vWF轴抑制剂在开发中,且都具有抗血栓形成的作用。
实例:针对GPIb或vWF的抗体、源自蛇毒的GPIb拮抗剂、抗vWF核酸适配体以及重组GPIb或vWF片段。
PI3Kβ抑制剂
PI3Ks是脂质激酶家族成员之一,其中PI3Kβ对GPIb、P2Y12和GPIIb/IIIa等血小板受体下游信号传导通路非常重要。另外PI3Kβ在介导剪切应力下稳定的血小板黏附中也具有重要作用。
实例:阿斯利康的PI3Kβ异构体特异性抑制剂AZD6482正处于临床试验阶段。
PAR-4拮抗剂
与PAR1相比,PAR4会参与到血小板活化的后期,并且在高浓度凝血酶存在下介导血小板聚集体的稳定化。PAR-4对凝血酶受体表现出较低的亲和力,并且与PAR-1相比仅与高浓度的凝血酶结合。在低浓度凝血酶下PAR-1活化对于止血非常重要,而高浓度凝血酶下的PAR4活化则可导致闭塞性血栓形成。所以靶向PAR-4可以更有选择性地减少血栓性闭塞,同时不阻止PAR-1信号通路而维持止血功能。
实例:百时美施贵宝的PAR4拮抗剂BMS-986120在动物试验中表现出与氯吡格雷相似的抗血栓形成能力,但对止血的影响很小。
抗血小板药物在心血管疾病的治疗中发挥着重要作用,但其临床应用受到多方面的影响,比如抗血小板抗性、广泛的变异性以及增加的出血风险。幸运的是,我们已对很多问题有了更清晰的认识,例如,过去十年的研究使人们更深入地了解了调节血栓形成和止血的分子机制,以及两者之间的差异,未来必将出现能够选择性抑制病理性血栓形成而不影响止血的抗血小板疗法。
为了改善抗血小板治疗,现在研究人员更加关注新的靶点。目前已有多种在研的新型抗血栓形成疗法,它们在临床前动物模型中显示出了很好的前景。这些创新疗法如何与现有的治疗方式结合,以及能否带来临床上更安全的抗血小板治疗组合仍待观察。不过,我们正迎来一个抗血小板药物开发的新时代,希望这将为越来越多的患者提供安全有效的治疗。(凯莱英供稿)
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐