优势与挑战并存,基于风险的监查是大势所趋
- 2020-05-25 14:23
- 作者:
- 来源:天津市药物临床研究技术创新中心
药物的研发是医药行业的核心,也是推动临床治疗方案不断提升的强力引擎。药物研究开发过程中,药物临床试验是一个非常重要的环节。我国正处于临床研究逐步发展的时期,各项法律法规的实施还有待不断完善,但毋庸置疑的是:质量的控制环节是国内企业的重中之重。
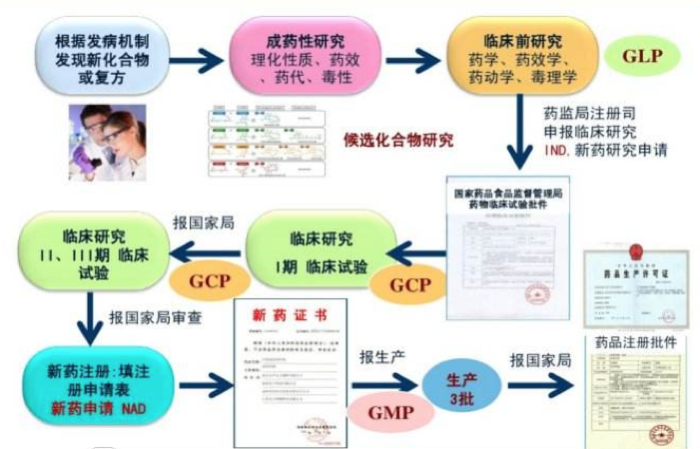
图一:药物研制、上市的关键环节
监查是药物临床试验进行质量控制的重要措施之一,其中现场监查是最为常见的一种传统监查访视方式。随着电子数据采集系统的广泛应用,临床试验复杂性增加,第三方参与增多。欧美制药企业、药监部门及学术界开展了一系列调研和探讨活动,旨在比较监查中所用方法的成本效益比,以达到最大化利用监查资源的目的。基于调研结果,他们提倡制定基于风险分析的监查,探索最合适的监查方式,来提高临床试验质量和效率。
基于风险监查的概念和目的
基于风险监查(RBM)是以中心化和非现场的方式,整体全面地监查关键指标和流程,识别影响临床试验质量和患者权益的风险,对最可能出问题的重要环节进行风险评估,包括出现的可能性和影响程度,从而针对这些关键的风险因素进行有效监查,更有效地提高数据可靠性和受试者安全,避免资源浪费。
针对国内外临床试验相关的法规和指导原则,我们可以从不同的角度去理解RBM的目的:
FDA指南将受试者保护和数据质量确定为RBM的总体目的。
EMA侧重于改变昂贵的质量管理体系,改善临床试验中的质量保证和质量控制。
MCC的调查结果:采用RBM的三个主要原因是降低监查成本(78%受访者选择)、提高数据质量(66%)和改善质量监督(66%)。
基于风险监查的应用与挑战
RBM的优势
作为质控活动的基础,RBM是一种适应性的临床试验监查方法,能够将监查重点和活动,侧重于受试者安全与数据质量等最为需要的方面。事实上,在FDA和ICH推荐RBM方法之前,很多美国国立卫生研究院资助的试验、英国医学研究理事会资助的试验、国际心肌梗死生存研究等已经使用中心化监查或其他替代监查方法,很好地保证了试验质量。正是这些非商业的临床试验的成功范例,让FDA意识到申办方也可制定RBM策略和计划。
临床研究组织协会(ACRO)对组织成员在临床试验中运用RBM的情况进行了调查,结果表明:采用RBM方法,加快了质量审核流程,由申办方对临床试验进行针对性监查,节省时间、人力成本,使临床试验质量核查更加有效。当公司通过RBM模型核查数据时,合同研究组织(CRO)与申办方更有可能更早地检测到质量问题,并在临床试验现场进行快速整改。并且,与100%的SDV和现场核查相比,RBM的时间消耗和资源消耗更少,在确保受试者权益受到保护以及保证研究数据的质量和完整性方面都起着关键作用。
另外,在国外文章Risk-Based MonitoringVersus Source Data Verification中,作者选取美国9个中心,对大约500名受试者进行了IV期试验:受试者接种单剂量疫苗,通过日志卡记录九天内健康方面的任何变化,并将结果输入EDC中。采用MANA RBM和传统监查方式,在质量、成本、时间等方面进行比较,结果如下表所示:
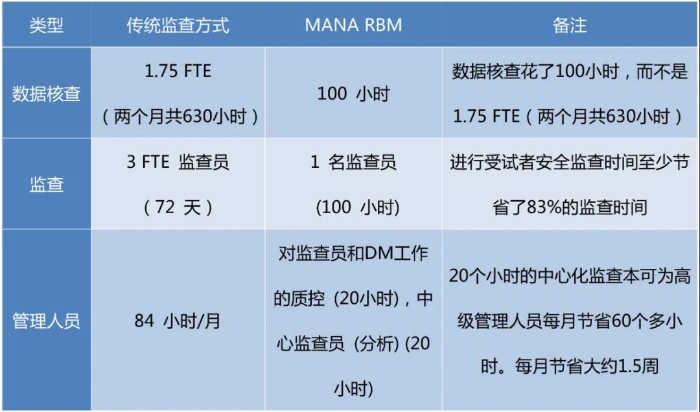
目前,国内外较多新药Ⅳ期临床试验最常采用RBM模式,最新FDA指导原则建议在Ⅱ期、Ⅲ期和Ⅳ期试验中开放使用,同时FDA也强调临床试验的监查可以有不同形式并存,建议的监查计划是针对试验的具体数据可靠性和受试者权益的关键风险而制定的。以目前国内外临床试验的现状来看,基于风险的监查模式是大势所趋。
RBM的挑战
然而,自RBM被提出后,在国内推广期间,对申办方、研究机构和CRO的系统层面(硬件)和临床试验层面(软件)上的要求却更高,甚至会增加成本。首先,RBM模式要求具备新的临床研究工具:EDC电子化、中心化读片、中心实验室、中心化药物警戒、中心化心电图、临床研究管理系统(CTMS)等,这将在一定程度上增加临床试验的前期成本,更重要的是要保证这些软件工具设计的背景、内容和框架可以保证确定关键数据和发现有关风险。RBM模式对申办方或CRO的IT系统提出了新的要求。针对IT系统的SOP必须涵盖系统的建立、安装和使用。SOP必须对系统验证、功能测试、数据收集、数据管理、系统维护、系统安全、变更控制、数据备份、数据恢复、临时措施和系统撤销等功能进行详细描述。使用系统的人员需要经过相应的培训。对数据库的说明文件一样需要有良好的质控措施,例如软件更新和数据传输都需要有相应的记录。
其次,RBM模式对临床试验的程序提出了更高要求。制定监查计划时要考虑风险因素,保护受试者、保证数据的准确完整,包含监查策略、监查工作的各方责任、不同的监查方法及采用各种监查方法的原理,应当强调关键的数据和程序,同时还要特别注意那些一般的临床研究中通常没有的部分,并提供相应的培训。监查计划要参考相关的法规和程序;撰写监查报告必须更为规范、更加全面,需要记录监查员在监查过程中的各种发现、对各种风险的处理过程以及对风险的防范措施,还应当涵盖中心化监查的内容。另一方面,RBM模式也要求临床试验从业人员更专业和具备经验。监查员应能熟练应用CTMS、EDC、eTMF、中央化随机系统(IVRS)、中心实验室等中心化监查工具,及时综合数据完成中枢整合,从中发现系统的问题和风险,从中分析原因并给予以干预或预防措施。另外,有能力对收集的数据进行远程评估的数据管理人员和统计师也不可或缺,可以协助监查员更好地进行RBM。
RBM模式关注临床研究中的关键数据和流程,在ICH、FDA的强力推动下,越来越被临床试验行业认识和应用,其提高数据可靠性和受试者安全的监查模式,有利于提升临床试验整体的质量水平。对于中国制药工业来说,为提高药物研发和审评的质量和水平,国家药品监管部门在技术指导文件和监管法律法规层面上逐步实现与国际接轨,RBM将有利于提高我国药物临床试验的质量水平,同时也是一个巨大的挑战。
为了更好地认识和引入RBM,需要了解和学习相关指导原则,快速运用,提升工作效率。(天津市药物临床研究技术创新中心)
附表:基于风险监查涉及的法规、指导原则

本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐