2020盘点:FDA批准的53个新药(四)
- 2020-12-31 11:04
- 作者:魏利军
- 来源:中国食品药品网
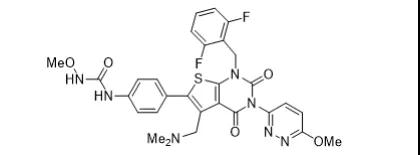
40.Gavreto(pralsetinib)
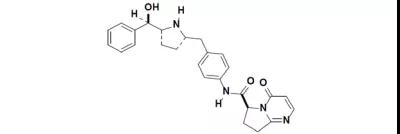
9月4日,FDA加速批准了Blueprint Medicines公司的pralsetinib用于RET融合阳性的成人转移性NSCLC治疗。Pralsetinib是一种RET激酶抑制剂,是2020年度第二个获批用于RET阳性NSCLC的药物,尚在开发阶段的适应证主要是甲状腺癌。EVP预测该产品在2026年的销售额可达1.09亿美元。
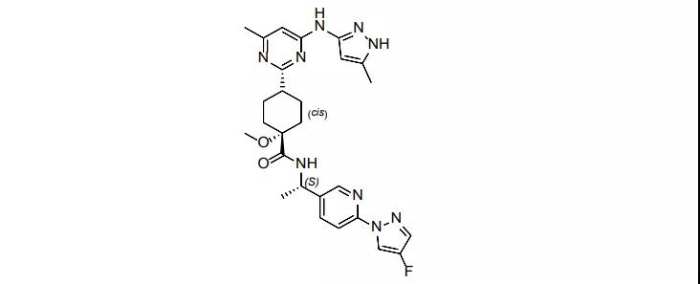
41.Inmazeb(atoltivimab,maftivimab,odesivimab-ebgn)
10月14日,FDA批准再生元的抗Zaire埃博拉病毒新药Inmazeb上市。该产品由三种可抑Zaire埃博拉病毒的抗体组成,虽然Inmazeb的疗效并不完全令人满意,但实现了埃博拉治疗史上的从“无”到“有”。
42.Veklury(瑞德西韦)
10月22日,FDA批准吉利德的瑞德西韦,用于12岁及以上年龄段需要住院的2019年新冠肺炎病毒(COVID-19)感染者治疗。尽管瑞德西韦已在日本和欧盟获批,但该产品的疗效依然饱受争议,WHO通过大数据分析认为该产品对住院患者帮助甚微或没有帮助。不过,吉利德三季度财报显示,该产品在2020年前三季度的销售额就已达8.73亿美元,全年销售额可能超过10亿美元。
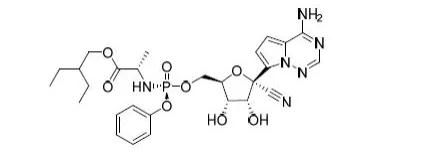
43.Zokinvy(Lonafarnib)
11月20日,FDA批准Eiger Biopharm公司的Lonafarnib上市,用于降低Hutchinson-Gilford早衰综合症(HGPS)死亡风险,或杂合子LMNA基因突变与纯合子/复合杂合子ZMPSTE24基因突变所致的加工缺陷型类早衰核纤层蛋白病治疗。HGPS是非常罕见的疾病,患病率约为二千万分之一,患病情况无种族、性别、地域差异。该病由LMNA突变产生法尼基化异常的早衰蛋白引起,最终主要因心衰死亡,平均死亡年龄为14.6岁。Zokinvy是一种口服法尼基转移酶抑制剂,可预防缺陷型早老蛋白或早老蛋白样蛋白聚集。市场潜力方面,EVP预测该产品在2026年的销售额可达0.99亿美元。
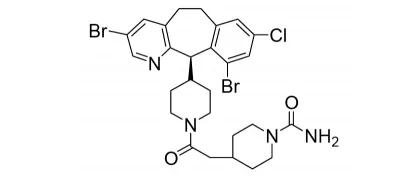
44.Oxlumo(lumasiran)
11月23日,FDA批准了Alnylam公司的RNAi药物lumasiran,用于1型原发性高草酸尿症(PH1)治疗。原发性高草酸尿症(PHs)是由编码丙氨酸-乙醛酸氨基转移酶的基因突变所引起的罕见遗传病,在西方国家的患病率为十五万分之一。基因缺陷所致的丙氨酸-乙醛酸氨基转移酶缺乏,可引起草酸生成异常升高,而Lumasiran是一种干扰RNA,可沉默编码HAO1(乙醇酸氧化酶)的mRNA,HAO1缺失可导致从乙醇酸到乙醛酸的转化过程受阻,进而影响草酸的合成。Lumasiran是首个获批用于该疾病治疗的药物,EVP预测该产品在2026年的销售额为2.53亿美元。
45.Imcivree(Setmelanotide)
11月25日,FDA批准Rhythm Pharma的多肽药物setmelanotide上市,用于前阿黑皮素原(POMC)、前蛋白转化酶枯草溶菌素1(PCSK1)或瘦素受体(LEPR)基因缺陷所致肥胖的6岁以上儿童或成人患者的慢性体重管理。Setmelanotide是一种选择性黑皮质素(MC)4受体激动剂,大脑中的MC4受体参与饥饿、饱腹感和能量消耗调节,而POMC、PCSK1和LEPR缺陷所致的肥胖,被认为与MC4受体激活不足有关。文献显示,POMC、PCSK1和LEPR基因缺陷的早发型严重肥胖患者不足5%,但市场潜力依然巨大,EVP预测该产品在2026年的销售额可达9.55亿美元。
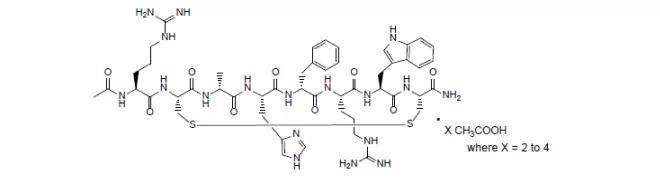
46.Danyelza(naxitamab-gqgk)
同在11月25日,FDA还加速批准了Y-Mabstherap公司的naxitamab,适应证是与粒细胞-巨噬细胞集落刺激因子(GM-CSF)联用,治疗骨骼和骨髓复发或难治性高危神经母细胞瘤患者(一岁及以上)。除了神经母细胞瘤,本品在开发的适应证主要是骨肉瘤。EVP预测该产品在2026年的销售额为2.47亿美元。
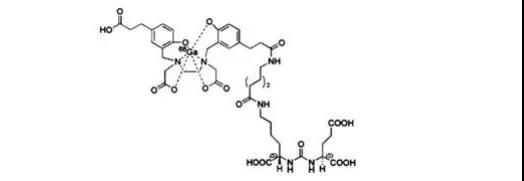
47.GalliumGa68PSMA-11(PSMA-11Ga68)
12月1日,FDA批准了加州大学洛杉矶分校开发的PET成像剂,用于前列腺特异膜抗原(PSMA)阳性的前列腺癌患者的病灶转移或复发情况分析。Ga68是一种正电子放射性核素,通过络合反应链接到可与PSMA特异性结合的载体上。
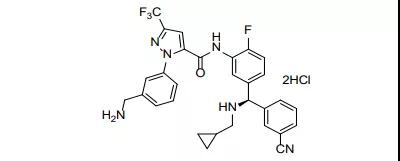
48.Orladeyo(berotralstat)
12月3日,FDA批准Bio Cryst公司的berotralstat上市,用于12岁以上儿童或成人遗传性血管性水肿发作预防。Berotralstat是一种口服血浆激肽释放酶抑制剂,尽管已经有多个产品获批用于HAE,但本品具有口服的优势。EVP预测本品在2026年的销售额可达3.26亿美元。
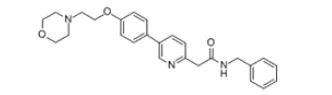
49.Klisyri(tirbanibulin)
12月14日,FDA批准了Athenex公司的tirbanibulin,用于面部或头皮的光化性角化病(AK)的局部治疗。Klisyri是一种软膏剂,含有1%的微管蛋白抑制剂tirbanibulin。AK是一种慢性疾病,主要分布在阳光直射的皮肤区域,据估计每年有0.025%至16%的AK病斑最终转化为浸润性鳞状细胞癌。目前尚无权威的AK发病率,据MahizerYaldiz报道,AK在54786受访者中的患病率为2.50%,患病情况与年龄正相关,80岁以上人群患病率高达14.57%。EVP预测该产品在2026年的销售额可达1.33亿美元。
50.Margenza(margetuximab-cmkb)
12月16日,FDA批准Macro Genics公司的margetuximab上市,适应证是与化疗联用,治疗既往接受过两种及以上抗HER2方案治疗的转移性HER2阳性乳腺癌成年患者。Margetuximab是一种新型HER2抗体,HER2阳性患者约占乳腺癌的15%,尽管已有多个HER2阳性的乳腺癌疗法获批,但仍存在未满足的临床需求。另外,margetuximab还在开发胃癌、食道癌等适应证。EVP预测该产品在2026年的销售额为2.77亿美元。
51.Orgovyx(relugolix)
12月18日,FDA批准了Myovant公司的relugolix,用于治疗晚期前列腺癌成人患者。Relugolix是一种口服非肽类促性腺激素释放激素(GnRH)受体阻断剂,由武田、ASKA和Myovant共同开发,此前已在日本获批用于子宫肌瘤治疗。除了子宫肌瘤、前列腺癌,本品还在开发子宫内膜异位症引起的疼痛、痛经等适应证。EVP预测该产品在2026年的销售额为1.74亿美元。
52.Ebanga(Ansuvimab-zykl)
2020年12月21日,FDA批准RidgebackBiotherap公司开发的ansuvimab上市,用于治疗成人和儿童的Zaire埃博拉病毒感染。Zaire埃博拉病毒是4种埃博拉病毒的一种,在此之前,FDA曾批准了Inmazeb对抗该病毒。Ebanga是一种糖蛋白抑制剂,可阻断病毒与细胞受体的结合,阻止其进入细胞。
53.Gemtesa(vibegron)
12月23日,FDA批准了UrovantSciences的vibegron,用于伴有尿频、尿急、尿失禁的膀胱过度活动症(OAB)成人患者治疗。Vibegron是一种肾上腺素β3受体激动剂,作用机制与米拉贝隆相同,最早于2018年在日本获批上市。OAB是一种较为常见的疾病,流行病学数据显示,40岁以上东亚人群的总体患病率高达20.8%,其中女性为22.1%,男性19.5%,患病情况与年龄存在正相关,从40-44岁年龄段的10.8%逐渐上升到60岁以上年龄段的27.9%。EVP预测该产品在2026年的销售额可达4.25亿美元。(药事纵横 魏利军)
本文的销售额预测数据均来自Evaluate Pharma网站公开文章。本文已征得作者同意刊发,未经许可不得转载。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐