新环境下高速发展的中国创新药和2018-2020年获批1类新药(上)
- 2021-01-05 10:32
- 作者:魏利军
- 来源:中国食品药品网
创新是民族进步的灵魂,是社会发展的源动力,国家对创新药的发展给予了高度重视,通过多个维度政策的引导和推动,我国创新药研发环境逐渐形成。在过去的3年里,共有31个1类新药获国家药品监督管理局批准上市。
创新药的新环境
我国创新药起步较晚,但近年来发展非常迅速。2010年以前,仅有个别企业开展me-too产品的研发。2011~2015年间,艾瑞昔布、埃克替尼、康柏西普、马林硝唑、阿帕替尼和西达本胺等产品的获批,大幅加快了我国创新药的发展。随着药品审评审批制度改革的深入推进,我国创新药发展进入了崭新的历史阶段。
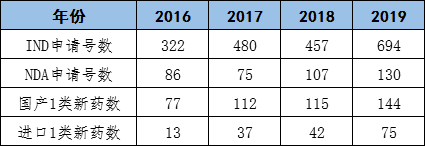
2016年以来,我国创新药的临床申请(IND)和新药申请(NDA)数量逐年稳步增加,而且2018年、2019年和2020年,分别有9个、9个和13个1类创新药(包括化学药和治疗性生物制品,不包括中药、疫苗、细胞制品、血液制品等不被FDA界定为新药的产品,下同)获得批准(含有条件批准,下同)上市,在数量上超过日本和欧洲主要创新药强国的同期水平。在质量上,泽布替尼获得美国FDA批准上市,意味着我国创新药开始走向世界,而且在不远的将来,康柏西普、恩沙替尼“国产”PD-1单抗也将走出国门,成为世界公认的“新分子实体”。近年来我国创新药的飞速发展,离不开国家良好的创新药政策环境和快速发展的创新药市场的刺激。
CDE受理的创新药申请情况变化(来源:CDE年度审评报告)
(一)政策环境
审评审批方面,2015年以来,国家多次发文,从多个维度鼓励和推动创新药研发。2015年,国务院颁布《国务院关于改革药品医疗器械审评审批制度的意见》,提出鼓励研究和创制新药,并加快创新药审评审批;2016年,原国家食品药品监督管理总局出台《关于发布化学药品注册分类改革工作方案的公告》,对创新药进行重新界定,指出创新药不仅要“中国新”,而且要满足“全球新”;2017年,国务院发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,提出改革临床试验管理、加快上市审评审批、促进药品创新和仿制药发展,并推出一系列措施,为创新药的研发、申报扫清障碍。
资金支持方面,除了国家重大科技专项和地方科技项目基金支持外,部分地方政府也陆续推出相关政策,为创新药的研发提供资金支持。例如,2018年,安徽省出台了《支持现代医疗和医药产业发展若干政策》,对创新药的研发最高给予1000万元的补助;2019年,河北省发布了《关于支持生物医药产业高质量发展的若干政策》,对进入Ⅱ期、Ⅲ期临床试验研究的创新药(不同剂型合并计算),分别给予300万元、500万元省战略性新兴产业专项资金奖励。
市场准入方面,多个省份为创新药的准入开辟了绿色通道。2018年,辽宁省发布《关于公布并执行辽宁省2018年医疗机构药品集中采购联合议价结果的通知》,率先明确对新批准上市创新药品进行联合议价,议价成功的药品实施挂网采购。继辽宁之后,广西壮族自治区在2019年发布《关于开设创新药品种直接挂网采购绿色通道》的通知。浙江省发布《关于公开征求过一致性评价仿制药和1类新药挂网采购文件意见建议的通知》,也相继给予创新药挂网采购的政策支持,使得创新药的准入周期大幅缩短。
医保支付方面,国家医保局推出了“仿制药带量采购”的政策,有效解决了创新药医保支付能力不足的问题。通过每年一次“谈判入医保”的方式,使得创新药都具有第一时间进入医保目录的机会。在2020年获得批准的13个本土1类创新药中,可洛派韦、阿美替尼、泽布替尼和依达拉奉右莰醇等4个产品已被纳入2020版医保目录,在惠及患者的同时,药企也直接获益。
(二)市场环境
在过去的几十年里,全球药品市场稳步增长,根据IQVIA数据,2019年全球药品支出已达1.25万亿美元,其中约七成来自创新药消费。截至目前,我国已超越日本,成为全球第二大药品市场,2019年药品支出达1416亿美元。PDB样本医院数据显示,国家药品监管部门自2011~2019年批准的29个1类新药在2019年的总销售额为27.6亿元,5年复合增长率达46.53%,2019年医保扩容之后,增长进一步加快,仅2020年一季度,以上29个产品的销售额就达15.8亿元,2020全年的同比增长率将超过100%。
一方面,丰厚的创新药投资回报,刺激企业重金投资研发;另一方面则在“仿制药集中采购”政策的推动下,我国的医药市场结构开始逐渐向欧美等发达国家“靠拢”,随着仿制药价格的不断下降,仿制药将不再是我国医药市场的主要增长点,迫使制药企业把目光转向创新药研发。随着国际交流的日益频繁,我国创新药研发也开始逐渐向国际接轨,国外的信息、技术、资本能够第一时间涌入国内,而国内的创新药也开始逐步走向世界。根据科睿唯安数据,在过去的3年里,有近40个研发项目被授权到海外(license-out)。2019年以来,石药集团的改良型新药左旋氨氯地平和百济神州的泽布替尼获得美国FDA批准上市,代表着我国创新药开始从“中国新”迈向“全球新”的全新历史阶段。
除了自主研发,投资并购也是获得创新药的主要方式。近年来,我国医药行业海外合作、海外投资的规模正在迅速扩大。根据科睿唯安数据,近年来license-in的交易数量呈迅速上升的趋势,由2015年的39项逐年增加至2019年的89项,以尼拉帕利、拉维达韦为代表的1类license-in型创新药相继获得国家药监局批准上市,大大丰富了临床治疗需求,同时有效降低了患者的治疗成本。
2018-2020年国家药监局批准的1类新药
随着药品审评审批制度改革的启动以及中国药品监管机构加入国际人用药品注册技术协调会(ICH),国家药品监管部门实行了临床申请默许制,开通了“优先审评”“快速通道”“突破性疗法”和“有条件批准”等特殊审评审批通道,有效加快了创新药的开发速度,使得我国本土创新药能够与国外竞品几乎同步上市(如PD-1单抗),甚至部分产品还能够领先美欧日,率先在中国上市(如罗沙司他)。
在短短的几年时间里,我国的创新药政策取得了卓越成效。2018年以来,国家药监局共批准了31个1类新药上市,这些产品主要分布在抗肿瘤(15个)、抗感染(8个)、精神神经类(4个)等三大治疗领域,包括6个生物制品和27个小分子化药。
(一)重组细胞因子基因衍生蛋白
2018年4月12日,国家药监局批准了杰华生物的重组细胞因子基因衍生蛋白注射液(乐复能),用于乙肝e抗原(HBeAg)阳性的慢性乙型肝炎治疗。重组细胞因子基因衍生蛋白是一种具有干扰素活性的非天然重组蛋白质,由166个氨基酸构成,分子量为19.3KD。因为本品具有干扰素类似的生理功能,故还有望用于肿瘤和新冠病毒感染治疗,相关临床试验正在开展中。
(二)安罗替尼
2018年5月8日,国家药监局通过优先审评审批程序批准了正大天晴的安罗替尼胶囊(福可维),用于晚期或转移性非小细胞肺癌(NSCLC)治疗。安罗替尼是索拉非尼的改构,是一种血管内皮细胞生长因子受体(VEGFR)、成纤维细胞生长因子受体(FGFR)、干细胞因子受体(c-KIT)和血小板源生长因子受体(PDGFR)的多靶点抑制剂。据国家癌症中心数据,我国2015年新发肺癌病例高达78.7万例,而NSCLC约占肺癌的80%-85%,治疗需求巨大。米内网数据显示,该产品在2019年的销售额达30亿元。除了NSCLC三线治疗,该产品还有多个适应症处于临床开发中,其中腺泡状软组织肉瘤、直肠癌、胃癌、平滑肌肉瘤、滑膜肉瘤、鼻咽癌、甲状腺癌已经处于3期临床阶段。
(三)艾博韦泰
2018年5月23日,国家药监局批准了前沿生物的艾博韦泰(艾可宁),用于治疗经抗病毒药物治疗后仍有病毒复制的HIV-1感染。艾博韦泰是全球首个长效HIV-1融合抑制剂,给药频率为每周一次。
(四)达诺瑞韦钠
2018年6月8日,国家药监局批准歌礼药业的NS3/4A蛋白酶抑制剂达诺瑞韦钠片(戈诺卫)上市,适应证是与利托那韦、聚乙二醇干扰素(PEG-IFN)和利巴韦林联用,治疗基因1b型无肝硬化的慢性丙型肝炎初治患者。尽管吉里德、艾伯维和默沙东等制药巨头的三代丙肝鸡尾酒陆续进入国内,但本品仍可以通过低价策略赢得一部分市场份额。米内数据显示,本在2019年的销售额已超过1亿元。
(五)吡咯替尼
2018年8月12日,国家药监局有条件批准了恒瑞医药的吡咯替尼片(艾瑞妮),用于复发或转移性乳腺癌治疗。吡咯替尼是一种不可逆的人表皮生长因子受体2(HER2)和表皮生长因子受体(EGFR)双相抑制剂,除了乳腺癌,本品处在临床后期的适应症主要是NSCLC和胃癌。由于乳腺癌患者基数较大,米内数据显示本品在2019年的销售额达8亿元。
(六)呋喹替尼
2018年9月4日,国家药监局通过优先审评审批程序批准了和记黄埔的呋喹替尼胶囊(爱优特),用于治疗既往接受过氟尿嘧啶类、奥沙利铂和伊立替康为基础的化疗,以及既往接受过或不适合接受抗血管内皮生长因子(VEGF)治疗、抗表皮生长因子受体(EGFR)治疗(RAS野生型)的转移性结直肠癌患者。直肠癌是我国发病率最高的几种癌症之一,年确诊人数高达37.6万,治疗需求巨大。米内数据显示该产品在2019年的销售额达1.8亿元。除了直肠癌,本品处在临床后期的适应症主要是胃癌和NSCLC。
(七)特瑞普利单抗
2018年12月17日,国家药监局有条件批准了君实生物的特瑞普利单抗注射液(拓益),用于既往标准治疗失败后的局部进展或转移性黑色素瘤治疗。特瑞普利单抗是首个国产PD-1(程序性死亡受体1)单抗。我国黑色素瘤年新发病例约为20000例,尽管患者基数不大,但米内数据显示,特瑞普利单抗在2019年的销售额高达8.7亿元。除了黑色素瘤,本品处于临床后期阶段的适应症包括鼻咽癌、泌尿生殖肿瘤、乳腺癌、肝癌、非小细胞肺癌、食道癌、肾癌、小细胞肺癌等,而且有多个适应症的临床试验在中美同时开展中。
(八)罗沙司他
2018年12月17日,国家药监局通过优先审评审批程序批准珐博进的罗沙司他胶囊(爱瑞卓)上市,用于慢性肾脏病(CKD)引起的贫血治疗。罗沙司他是全球首个小分子低氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI),继在中国获批后,日本也批准了该产品上市,并且有望在2021年上半年获得FDA的批准。由于CKD患者众多,本品作为首个促红素口服替代疗法,有望迅速成为一个重磅炸弹产品,EvaluatePharma预测该产品在2026年的全球销售额可达18.45亿美元。
(九)信迪利单抗
2018年12月24日,国家药监局通过优先审评审批程序批准了信达生物的信迪利单抗注射液(达伯舒),用于经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤(cHL)治疗。信迪利单抗是一种免疫球蛋白G(IgG4)型PD-1单抗,除了以上适应证,本品处于3期临床阶段的适应证还有肢端雀斑样黑色素瘤、胃癌、肝癌、鼻咽癌和食道癌等,米内数据显示本品在2019年的销售额达10亿元。
(十)聚乙二醇洛塞那肽
2019年5月5日,国家药监局批准了江苏豪森的聚乙二醇洛塞那肽(孚来美),适应证是配合饮食控制和运动,单药或与二甲双胍联合,用于改善成人2型糖尿病患者的血糖控制。本品是江苏豪森自主研发的GLP-1R(胰高血糖素样肽-1受体)激动剂,是一种聚乙二醇修饰的exendin-4,可以实现每周一次给药。我国是糖尿病人口大国,据2013年的流行病学研究数据显示,我国18周岁以上人群糖尿病患病率高达10.4%,治疗需求巨大,本品的上市将为数千万患者提供一种新的治疗选择。
(十一)本维莫德
2019年5月29日,国家药监局批准广东中昊药业的本维莫德乳膏(欣比克)上市,用于适合局部治疗的成人轻中度寻常型银屑病治疗。本维莫德是一个引进的品种,最早由WelichemBiotech公司开发,项目代号为WBI-1001,天济药业获得了本维莫德中国区的权益。本维莫德中国以外的开发权益由GSK获得,目前在开发银屑病、斑块银屑病(3期)和特应性皮炎等适应症(2期)。
(十二)卡瑞利珠单抗
2019年5月29日,国家药监局在批准本维莫德的同时,还批准了恒瑞的卡瑞利珠单抗。卡瑞利珠单抗是第三个获批上市的国产PD-1单抗,获批用于至少经过二线系统化疗的复发或难治性典型霍奇金淋巴瘤患者的治疗。目前相关的临床试验终点尚未达到,故国家药监局仅基于临床试验的客观缓解率和缓解持续时间结果给予有条件批准上市。卡瑞利珠单抗虽然是国家药监局批准的第五个PD-1单抗,但我国的治疗需求庞大,米内数据显示,该产品在当年的销售额就达10.79亿元。(魏利军 哈药集团股份有限公司立项部总监)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐