肿瘤精准治疗时代到来(上)
- 2021-01-12 16:00
- 作者:
- 来源:中国食品药品网
药物越来越多 应用越来越广
精准肿瘤治疗是通过靶向特定的生物过程和基因突变,或有针对性地增强个体免疫系统,为每位患者量身定制药物治疗方案,从而提升癌症医治的临床疗效。免疫肿瘤疗法可帮助患者激发自身免疫系统来对抗癌症。精准肿瘤治疗涵盖一系列制剂,如单克隆抗体、检查点抑制剂和免疫系统调节剂等。此外,针对个性化细胞产品(CAR细胞疗法)的临床研究也在不断发展中。通过预测性生物标志物测试,可以预测患者对某一疗法的响应,将助力医患作出精准的治疗选择。
精准肿瘤治疗始于20世纪70年代他莫昔芬(tamoxifen)上市,这是第一个治疗肿瘤细胞的靶向疗法。在20世纪90年代,监管机构批准了利用自身免疫系统破坏肿瘤细胞的免疫疗法。在2000年前后,基于预测性生物标志物的治疗方法和利用基因编程治疗癌症的细胞疗法也获批,肿瘤精准治疗药物更加个性化。在此过程中,人们对癌症的理解和认识实现了质的飞跃,这是肿瘤治疗的巨大进步,并且正朝着更先进的治疗方式发展。
美国与欧盟的药物创新
得益于精准肿瘤治疗的发展,肿瘤疗法不断实现创新突破。精准肿瘤治疗的药物越来越多,且应用范围也越来越广泛。2015~2019年,美国共上市60个肿瘤新活性物(NAS),涵盖24个癌症类型(见图1)。在此期间,这些药物共有115个新适应症获批,某些药物获批治疗多个适应症。在2015~2019年期间批准的所有NAS中,93%属于靶向疗法。
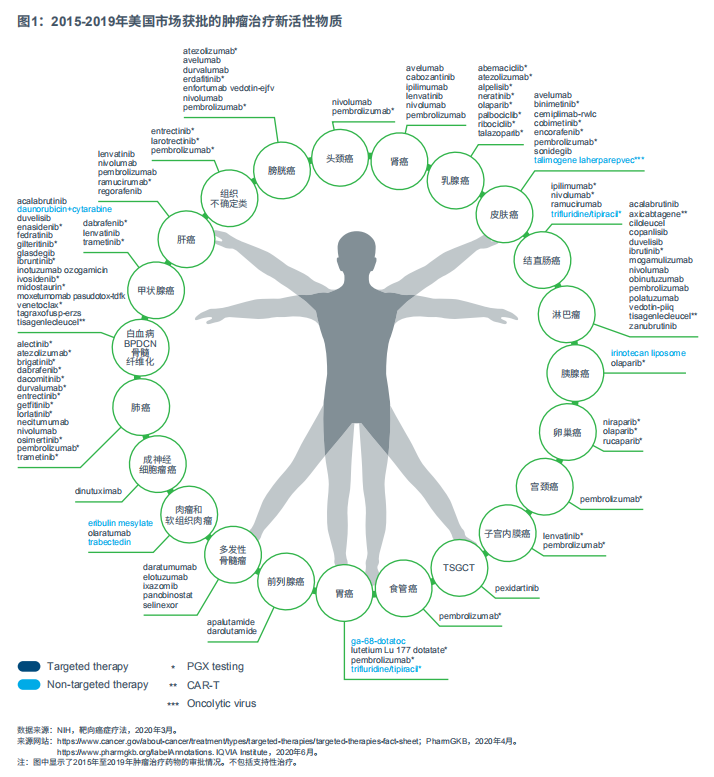
2019年,12种新疗法在美上市,包括11种靶向药物和1种诊断剂。其中25%(n=3)NAS与预测性生物标志物相关,还有两个获批用于伴随诊断。
在12个NAS药物中,8个为口服给药,方便患者不必前往输液中心或医院接受治疗。其中7个被美国FDA授予突破性疗法,6个加速获批,9个基于单一试验获批,而8个基于I期或II期试验申请批准,这表明FDA殷切希望创新疗法惠及广大患者。
2019年,美国FDA批准12个NAS用于治疗恶性血液肿瘤和实体瘤,而欧洲药品管理局(EMA)批准了9个。2019年EMA批准的这9个NAS均属于靶向疗法,其中五个与预测性生物标志物相关,还有两个被批准用于伴随诊断。2019年,EMA首次批准了组织不确定类药物larotrectinib,用于治疗NTRK基因融合的实体瘤。与FDA一样,EMA通过接受I期和II期试验数据(n=4)以及有条件的市场批准(n=4),在监管流程与创新肿瘤疗法的迫切需求之间达到平衡。值得注意的是,polatuzumab vedotin获得了EMA的优先审批,旨在通过加速药物评估来支持急需药物的研发。
美国癌症患者比欧洲癌症患者约早五个月接受最新癌症疗法,部分原因是欧洲的卫生技术评估程序对新癌症疗法的报销审批更为严苛(见图2)。2019年,同一药物在美国和欧洲的批准上市时间相差很大(数月)。这一差异很大程度上表现在新型诊断剂Ga-68-DOTATOC上,该诊断剂已于2016年在法国获批用于正电子发射体层显像(PET),以定位生长抑素受体表达阳性的神经内分泌瘤(NETs)。
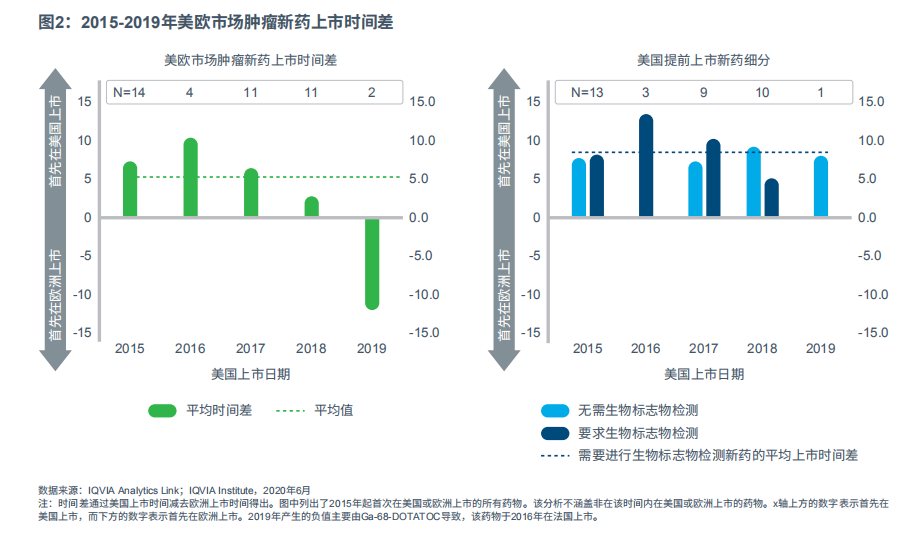
那些在用药前需进行药物基因组生物标志物检测的肿瘤药,在欧洲上市时间要晚于美国市场,平均时间相差长达九个月之久,部分原因是多变的诊断环境以及医疗系统利益相关方意识的不足,为此类产品进入欧洲市场带来了挑战。
精准肿瘤治疗药物的兴起
靶向肿瘤药物的数量不断增加,占2015~2019年期间美国批准的所有NAS的93%。靶向肿瘤疗法(以标准剂量单位衡量)也不断发展,在发达国家市场中,此类疗法的数量在过去10年间翻番。2009年至今,美国的靶向疗法数量增加了一倍,在欧洲五国整体也增加了一倍以上。
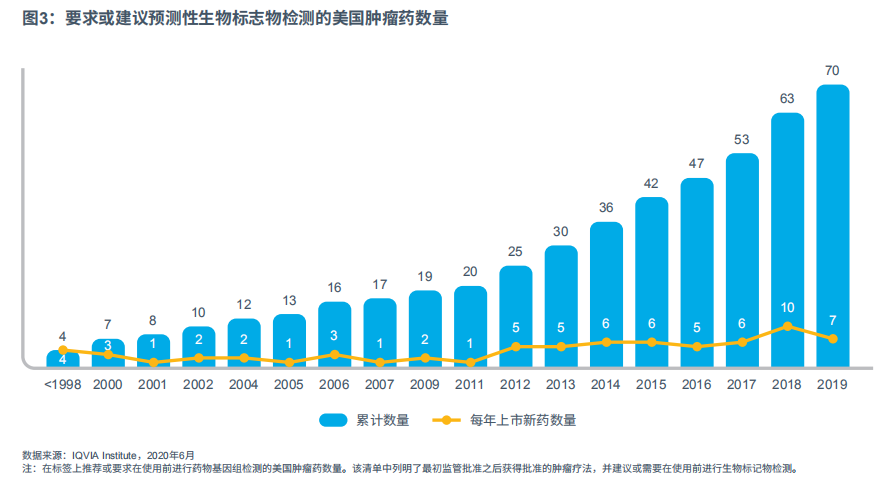
除靶向疗法外,2015~2019年在美国上市的肿瘤药物中有58%在用药前要求或建议进行生物标志物检测。预测生物标志物可确定哪些患者会对疗法产生最佳反应,或哪些患者更有可能出现不良反应,从而选择个性化疗法。至2019年,美国共有70种产品在标签上要求或建议在使用前进行生物标志物检测,相较于2015年增加了67%(见图3)。
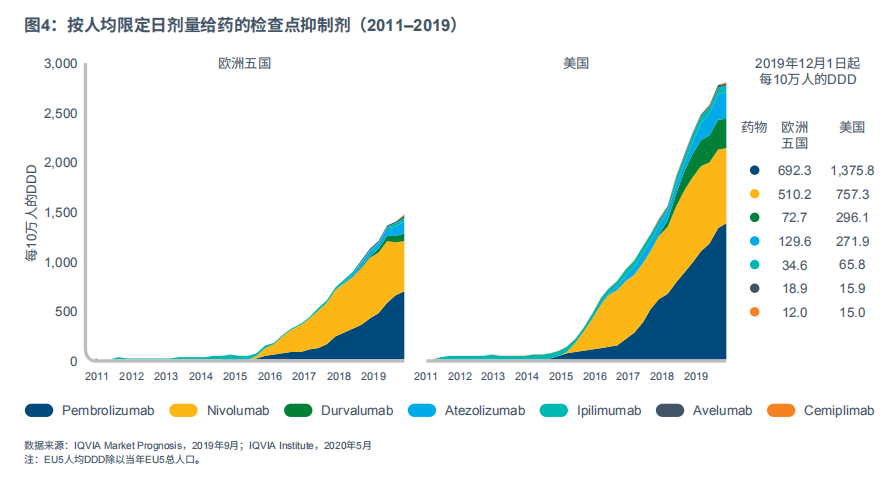
癌症靶向免疫肿瘤药物包括检查点抑制剂,此类抑制剂可阻断免疫检查点,然后激活患者的免疫系统来对抗肿瘤;这些药物已成功在先前难治性癌症中诱发了持久反应。自2011年以来,美国已批准7种检查点抑制剂,分别为:pembrolizumab、nivolumab、cemiplimab、atezolizumab、avelumab、durvalumab和ipilimumab。符合条件可接受检查点抑制剂治疗的癌症患者比例已从2011年的2%左右增加到2018年的44%,而对检查点抑制剂产生响应的癌症患者的比例也明显增加,从2011年的不足1%上升到2018年的13%左右。自2016年以来,美国此类药物的使用量(以标准剂量单位计量)已增加了一倍。
为评估美国和欧洲检查点抑制剂使用方面的变化,使用限定日剂量(DDD)进行标准化计量(以100,000人为基准)。
检查点抑制剂在美国的使用剂量急剧增加,自2014年起以111.4%CAGR增长,到2019年12月,每10万人的DDD达到2783(见图4)。尽管欧洲市场的CAGR与美国类似,达到114.9%,但使用剂量约为美国的一半,即每10万人的DDD为1470(见附录:限定日剂量)。导致美国和欧洲之间存在DDD差异的部分原因是PD-1抑制剂pembrolizumab在美国的使用剂量较高,各地区之间存在批准延迟问题,且检查点抑制剂在欧洲面临经济负担重、报销难的挑战。
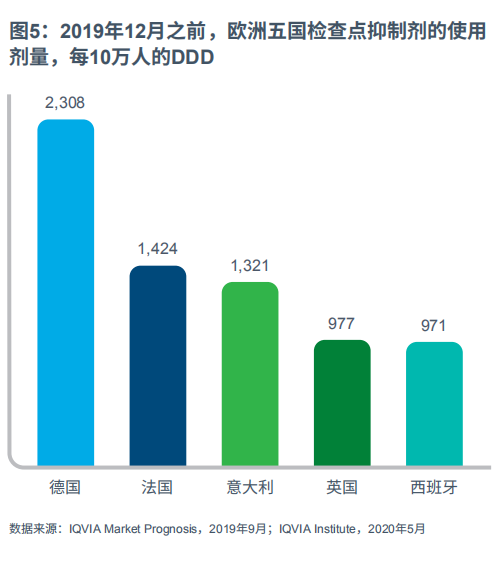
欧洲五国的检查点抑制剂使用量在各国均有所不同(见图5)。法国和德国的检查点抑制剂人均DDD较高,2019年12月每10万人的DDD分别达到1424和2308,部分原因是在这两国(与欧洲他国相比较),免疫疗法药物的HTA评估时间更短且更有优势,同时还因为抗癌疗法研发支出不断增加。西班牙每10万人的DDD最低(971),其次为英国(977),部分是由于市场准入和医保报销方面的问题所致。尽管意大利10万人DDD的总量低于德国和法国的水平,部分是因为cemiplimab和durvalumab的报销挑战,但nivolumab的使用剂量在法德之间,导致检查点抑制剂整体使用剂量高于西班牙与英国。
组织不确定类药物趋势
组织不确定类疗法是基于癌症的基因和分子特性,而不是癌变的人体器官组织。这种改变将成为癌症治疗的靶点,或用来预测哪些患者接受某种特定治疗更有效。通过组织不确定类疗法,医生可以根据癌细胞的基因和分子特征,而不是人体癌变器官来决定治疗方案,大大推动了个性化治疗的发展。
美国已批准三个组织不确定类肿瘤药物上市,即pembrolizumab、larotrectinib和entrectinib。2017年,pembrolizumab首次获批用于治疗MSI-H或dMMR阳性的实体瘤。Larotrectinib和entrectinib已获批用于治疗具有神经营养受体酪氨酸激酶(NTRK)基因融合的实体瘤。Larotrectinib于2019年末获EMA批准用于治疗NTRK基因融合实体瘤。
在美国,自2017年首个组织不确定类药物获批以来,这些药物的总使用剂量(标准剂量单位)增长了近4倍。
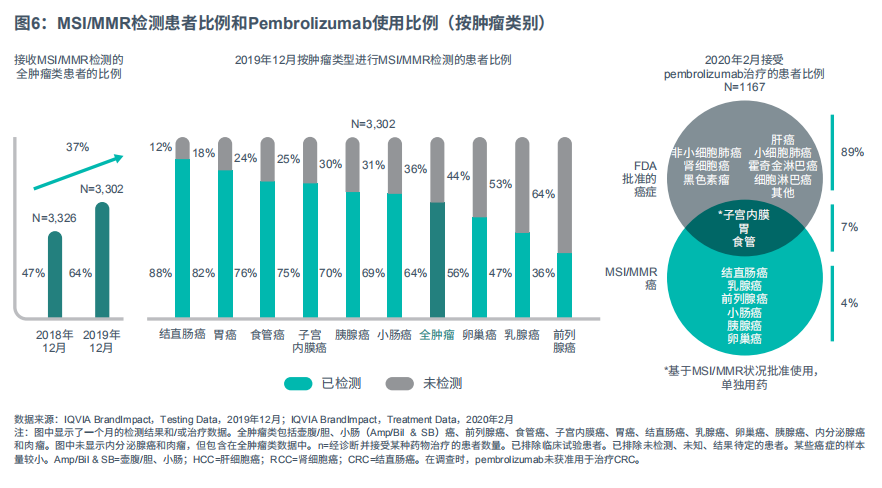
微卫星不稳定性突变影响DNA错配修复酶的产生,且发生此类突变的细胞无法修复DNA复制错误,这便增加了罹患癌症的风险。许多类型的肿瘤均存在此类突变,尤其是子宫内膜癌、结直肠癌和胃癌,其MSI-H/dMMR检测频率最为频繁(见图6)。Pembrolizumab和nivolumab已获批用于治疗MSI-H/dMMR检测阳性的特定肿瘤,如子宫内膜癌或结直肠癌。自2018年12月以来,在存在MSI-H/dMMR突变的癌症中使用pembrolizumab,MSI-H/dMMR的检测率增加了37%,部分原因是医生越来越认可检测的预测结果,预测哪些肿瘤患者可能会对检查点抑制剂产生响应。对于接受pembrolizumab治疗的患者,11%患有存在MSI-H/dMMR突变的癌症,这表明组织不确定类生物标志物在药物开发策略方面发挥重要作用,并能促进药物使用。
在组织不确定类药物的使用方面仍存在许多挑战。一方面,尽管这些突变可能出现在各种肿瘤中,但患者人数较少,NTRK基因融合突变在实体瘤中的比例约为1%。为使患者能够获得组织不确定类药物,还需要高质量的诊断基础设施,而在一些医疗系统中可能缺少此类设施,同时除了专家和学者以外,利益相关方也可能缺少对这些药物可及性方面的认识。
报销可能也会构成挑战,因为监管批准试验中仅纳入了少量受试患者,因此无法有效证明药物的临床疗效,而这反过来又会限制递交给支付方和卫生技术评估(HTA)机构的数据量。此外,用于证明疗效并获得监管批准的创新性试验设计对于一些HTA来说可能存在问题,如缺少有效的比较剂或替代终点。最后,一些患者可能无法负担这些试剂以及创新测序技术(NGS)的费用。(艾昆纬供稿)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐












