我国PDx市场未来展望(下)
- 2021-01-22 09:36
- 作者:
- 来源:中国食品药品网
各适应症的PDx格局及管线分析
适应症获批速度、临床试验结果、定价、推广策略以及医院覆盖等因素,决定了各PDx产品的市场表现。IQVIA通过外部访谈,对发病率高、国内市场较活跃的几个主要癌种中各PDx产品的市场表现与未来管线情况进行了分析。如图3,发病率高、患者群体大的肺癌、肝癌、食管癌,预计在未来3-4年的管线更为拥挤。尤其是非小细胞肺癌鳞癌与非鳞癌领域都将有超过10个PDx产品加入战场,其中还包括多个国产新药上市。未来PDx市场竞争会愈发激烈。
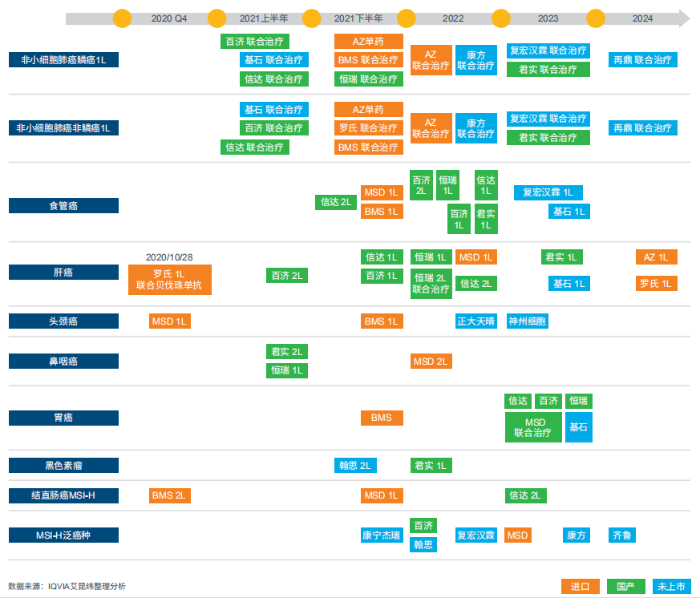
图3:PDx将获批的主要适应症时间线预计
非小细胞肺癌
肺癌是我国发病率最高的癌症,每年新发病人超过80万人。非小细胞肺癌在肺癌中占比85%,其中七成为非鳞癌,三成为鳞癌。非鳞癌中50%为EGFR/ALK阴性的患者,鳞癌中超过90%为突变阴性患者,均为PDx产品的目标患者群体。作为患者群最庞大的癌种,非小细胞肺癌市场已成为各大PDx产品的必争之地。
一线治疗中,K药率先在2019年获批非鳞癌联合治疗、鳞癌联合治疗,以及单药治疗(TPS≥1%),独占NSCLC 1L市场,其中鳞癌联合治疗和单药治疗目前均为独家获批药物,NSCLC 1L领域贡献了K药的过半销量。O药则是目前唯一获批NSCLC 2L适应症的PDx产品,在销售布局和进院都具有优势。然而,这些优势已经随着其他PDx产品的上市而逐渐弱化。O药的市场推广严格遵守合规,超适应症使用为自然销量,因此NSCLC 2L领域贡献了O药80%以上的销量。但由于国产PD-1在二线治疗的价格及推广优势,使得O药的销售表现受到较大冲击。
2020年6月艾瑞卡已获批一线联合治疗,达伯舒、百泽安和泰圣奇在一线的联合治疗方案也已经提交上市申请或已获批。预计到2021年上半年,一线治疗领域将会有至少五个PDx产品获批,市场将从之前的K药一家独大,变成MNC与多个国产产品竞争的局面。国产PDx产品价格更低,在推广方面也更具优势,这给价格较高的MNC产品将带来较大的冲击。
除了一线治疗,作为最早上市的PD-L1,英飞凡是目前唯一针对三期不可切的PDx产品。AZ在呼吸领域拥有易瑞沙、泰瑞沙的“双沙”团队,在肺癌领域深耕细作多年带来的医院、医生的资源,使得英飞凡具有天然的推广优势。
肝癌
2019年6月,艾瑞卡基于二期临床获得优先审批,有条件批准上市,并在2020年3月成为国内唯一获批HCC二线治疗的PD-1。由于临床数据公开早,艾瑞卡早已开始在肝癌领域的布局与学术推广,因此目前在消化肿瘤领域已经占据绝对优势。
相比较二线单药治疗,PDx联合抗血管内皮生长因子(anti-VEGF)药物,如贝伐珠单抗、仑伐替尼等,在一线联合治疗有着很好的优势。在PDx正式获批之前,“可乐”组合(K药与仑伐替尼)与“T+A”联合疗法(泰圣奇联合贝伐珠单抗)是一线主要的超适应症使用选择。目前,泰圣奇已在美国获批HCC 1L适应症,在我国也已提交一线联合治疗上市申请,并于2020年10月28日正式获批。首个获批HCC 1L适应症的优势,或会给泰圣奇带来销售增长。
肝癌管线的上市时间集中在2021年下半年到2022年,届时,百泽安、艾瑞卡联合化疗、达伯舒将获批二线治疗;达伯舒、百泽安、艾瑞卡、K药联合仑伐替尼,将获批一线治疗。肝癌PDx市场即将进入混战局面,早获批的艾瑞卡和泰圣奇会具备明显优势。
食管癌
食管癌的管线同样丰富。K药与艾瑞卡在2020年第二季度同时获批食管癌二线单药治疗,面临直接竞争。从2021年下半年开始,一线和二线治疗都将有新产品获批。预计2021年下半年和2022年达伯舒和百泽安将获批二线治疗。对比二线治疗,一线治疗管线更为拥挤,K药和O药预计在2021年下半年率先获批一线治疗,预计艾瑞卡、百泽安、达伯舒、拓益也将在2022年获批,2023年,新产品复宏汉霖和基石也将加入EC 1L市场。
鼻咽癌(NPC,NasopharyngealCarcinoma)
我国鼻咽癌发病率高于欧美国家,在头颈癌患者中占比超过40%,因此,国产PDx厂家更重视鼻咽癌的临床研发。进口PDx产品缺少鼻咽癌的样本结果,研发进展较慢,推广又严格根据获批适应症,因此在鼻咽癌领域优势不大。相较进口PD-1,艾瑞卡的优势是包含了鼻咽癌患者的临床试验,并且是国内PDx产品中最早在柳叶刀上发布鼻咽癌患者临床试验结果的产品。
目前艾瑞卡联合顺铂和吉西他滨一线治疗局部复发或远处转移鼻咽癌,以及拓益二线治疗均已提交上市申请,预计2021年上半年获批。进口PDx产品中K药在鼻咽癌中的进度最快,预计2022年获批二线治疗。
头颈癌(SCCHN,非鼻咽癌)
在SCCHN二线治疗中,O药已完成的临床试验中不包含鼻咽癌患者,因此获批的头颈癌适应症,并不包括鼻咽癌。由于O药合规严格,不会直接在鼻咽癌患者中直接推广,因此SCCHN二线治疗领域给O药带来的市场相对有限。
2020年12月,K药获批SCCHN一线治疗新适应症,成为最早获批头颈癌一线治疗的PDx产品。2021年和2022年,预计O药也将获批一线治疗,正大天晴和神州细胞的两个新PDx产品也将加入头颈癌市场。
黑色素瘤
目前国内黑色素瘤二线治疗获批的产品是K药和拓益,均在2018年获批。其他已上市国产PDx产品并未开展黑色素瘤临床试验研究,翰中生物的黑色素瘤二线治疗预计于2021年获批。而在一线治疗研究进展中,拓益早于K药,预计于2022年率先上市。
尿路上皮癌
目前UC 2L唯一获批的产品是百泽安。除此以外,拓益已提交上市申请,预计2021年上半年获批。K药的二线治疗已在美国获批,在我国尚未展开临床研究。艾瑞卡二期试验正在进行中。
其他癌种
除以上提到的主要癌种,RR cHL、胃癌、结肠癌(CRC)、MSI-H泛癌种的PDx市场也较为活跃。如RR cHL,作为目标患者群低于5000人的小适应症,成为了艾瑞卡、达伯舒、百泽安等诸多国产PDx产品用于率先获得上市获批的入场券,其中达伯舒更是成为第一个RR cHL进入医保的PDx产品,开启了PDx产品十万元以下市场的竞争态势。
胃癌同样作为患病率高的胃肠道癌种,研发进度慢于肝癌与食管癌。2020年3月,O药获批胃或胃食管连接部腺癌(GC)三线治疗,首个获批GC适应症,但是三线的病人数量有限,预计不会带来显著的销量增长。预计2023年会迎来多个PDx产品的获批,如K药、达伯舒、百泽安、艾瑞卡、基石等。
MSI-HCRC与MSI-H泛癌种目前国内尚未有产品获批。K药率先进入了MSI-H泛癌种治疗的领域,并已在美国FDA获批,预计2021年底会在国内获批MSI-HCRC1L治疗,并于2023年获批MSI-H泛癌种治疗。另外也有多种国产PDx产品致力于MSI-H癌种的临床研究,2021年开始,将会有康宁杰瑞、百济神州、翰思、复宏汉霖、康方、齐鲁等多个国产品牌进入该领域。
辅助与新辅助
现有PDx产品集中于晚期癌症患者的治疗,目前多个PDx产品正在进行针对更早期患者的辅助与新辅助试验,未来会使得更多癌症患者可以受益于免疫肿瘤治疗。目前,辅助与新辅助的临床研究也以进口PDx产品为主,如K药已经在美国获批黑色素瘤的辅助治疗。K药、O药、英飞凡和泰圣奇都有进展较快的国内临床试验,主要布局在肺癌、肝癌、食管癌和胃癌等。多个国产品牌也加入了辅助与新辅助的研究,如拓益在肺癌、肝癌等均布局了辅助与新辅助临床试验,预计2022年会公布肺癌(新)辅助的临床结果。虽然目前国内PDx产品在辅助与新辅助治疗领域仍然空白,但预计在主要适应症获批后,辅助与新辅助的PDx用药人群可以占到整体PDx用药人群的20%,进一步开拓PDx的整体市场。
PDx联合用药
免疫肿瘤单药治疗虽然已经大大提高了病人应答率和应答的持久性,但仍然有很大一部分患者对PDx产品无应答,或在使用PDx产品后疾病进展。免疫疗法联合其他药物,如联合化疗、抗VEGF药物、CTLA-4等,通过与免疫治疗药物的协同组合,或将免疫治疗剂与常规癌症治疗(例如放射治疗或靶向治疗)结合,通过免疫协同作用,或改善肿瘤微环境等,提高病人应答,是目前改善患者应答和疗效的最可行策略,也是目前研究的一大趋势。
根据Nature Reviews Drug Discovery文章,目前PDx联合治疗的全球临床试验中,涉及近300个不同的联合靶点药物,其中最热门的包括化疗、CTLA-4、VEGFR和放疗,除此之外,还包括PARP、IDO1、HDAC、EGFR、HER2、LAG-3、MEK、CD20等靶点,以及溶瘤病毒(OV,oncolytic viruses)、肿瘤相关抗原(TAA,tumour-associated antigen)等,更多新的靶点也正在探索中。最热门的当属免疫检查点抑制剂CTLA-4,如O药和伊匹单抗的联合,是通过PD-1单抗与CTLA-4单抗两个作用于抗肿瘤免疫的不同阶段的免疫检查点抑制剂,通过双免疫联合实现协同作用,已经在国外获批了黑色素瘤、肾细胞癌和高MSI/MMR缺陷的结直肠癌等多个适应症。
总结常见的联合用药研发方向,免疫肿瘤药物联合治疗主要涉及四种研究方向:通过广谱杀伤;提升免疫原性;即与放化疗;靶向药联用。目前已经有获批上市的联合用药,主要集中在与化疗、靶向药联用,如与免疫检查点抑制剂CTLA-4、抗肿瘤血管生成VEGF等联用,与白介素等联用以激活T细胞,增强免疫共刺激信号,与IFN-γ通路的受体如TLR7等联用,针对PD-1/L1通路,克服获得性耐药等多个不同的联合用药机制,都在前期临床研究过程中。
以K药为例,目前国内单药和联合用药在NSCLC一线均有获批,其中在PD-L1阳性患者中获批的是单药治疗,在EGFR-/ALK-中获批的则是与化疗联用,在Nonsq-NSCLC中联合培美曲塞、顺铂一线治疗,在Sq-NSCLC中则联合卡铂、紫杉醇或白蛋白紫杉醇进行一线治疗。另外,在HCC、EC等癌种中,PDx联合化疗或靶向药,临床结果优于单药治疗,例如前文提到的泰圣奇与贝伐单抗,K药与仑伐替尼在HCC1L的联用。
需要注意的是,免疫联合治疗在疗效明显优于单药治疗的同时,也带来了不容忽视的安全性问题,如何进行不良反应管理是临床需要解决的问题。如CTLA-4与PD-(L)1抗体药物联用时irAE(免疫相关不良反应,由于脱靶效应造成免疫系统过度激活而带来的毒性)比单药高。同时有研究证明,当肿瘤负荷低时,CTLA-4和PD-1的联合可能会损害人体抗肿瘤的免疫力,因为它会过度激活部分抗肿瘤T细胞,从而诱导IFN-γ(γ干扰素)依赖性的细胞死亡。由于大多数患者接受PDx治疗后会出现抗药性或复发,不断研究新的针对抗药性的联合靶点也是未来研究的一个方向。另外,双抗体也是PDx领域研究的一大热点。
综上所述,PDx作为目前炙手可热的市场,现有药物的竞争十分激烈,加之更为拥挤的研发管线,未来3~5年中谁能在PDx市场占据更大份额,关键取决于适应症布局、价格和医保策略、公司的销售和推广能力、产能和成本投入。已上市产品的适应症扩展、进入医保,以及新上市产品的加入,进一步增加了市场竞争的激烈程度,多个在研产品未来是否可以异军突起,都让PDx市场的格局难以预测。但可以预见的是,随着更多产品的上市,患者有了更多的选择,包括MNC在内的PDx厂家未来的价格会越来越低,大大减轻患者的疾病负担。随着更多适应症的获批,以及更多联合用药的探索,未来PDx产品会惠及更多患者。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
- 我国PDx市场未来展望(上)
-
为你推荐













