国家药监局明确医疗器械注册人备案人开展不良事件监测工作检查要点
- 2021-04-09 16:04
- 作者:
- 来源:国家药监局网站
4月9日,国家药监局综合司发布医疗器械注册人备案人开展不良事件监测工作检查要点的通知。全文如下。
国家药监局综合司关于印发医疗器械注册人备案人开展不良事件监测工作检查要点的通知
各省、自治区、直辖市药品监督管理局,新疆生产建设兵团药品监督管理局:
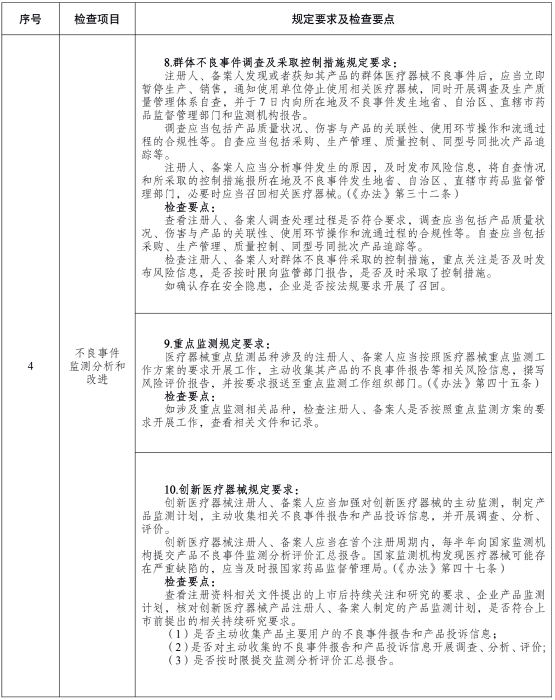
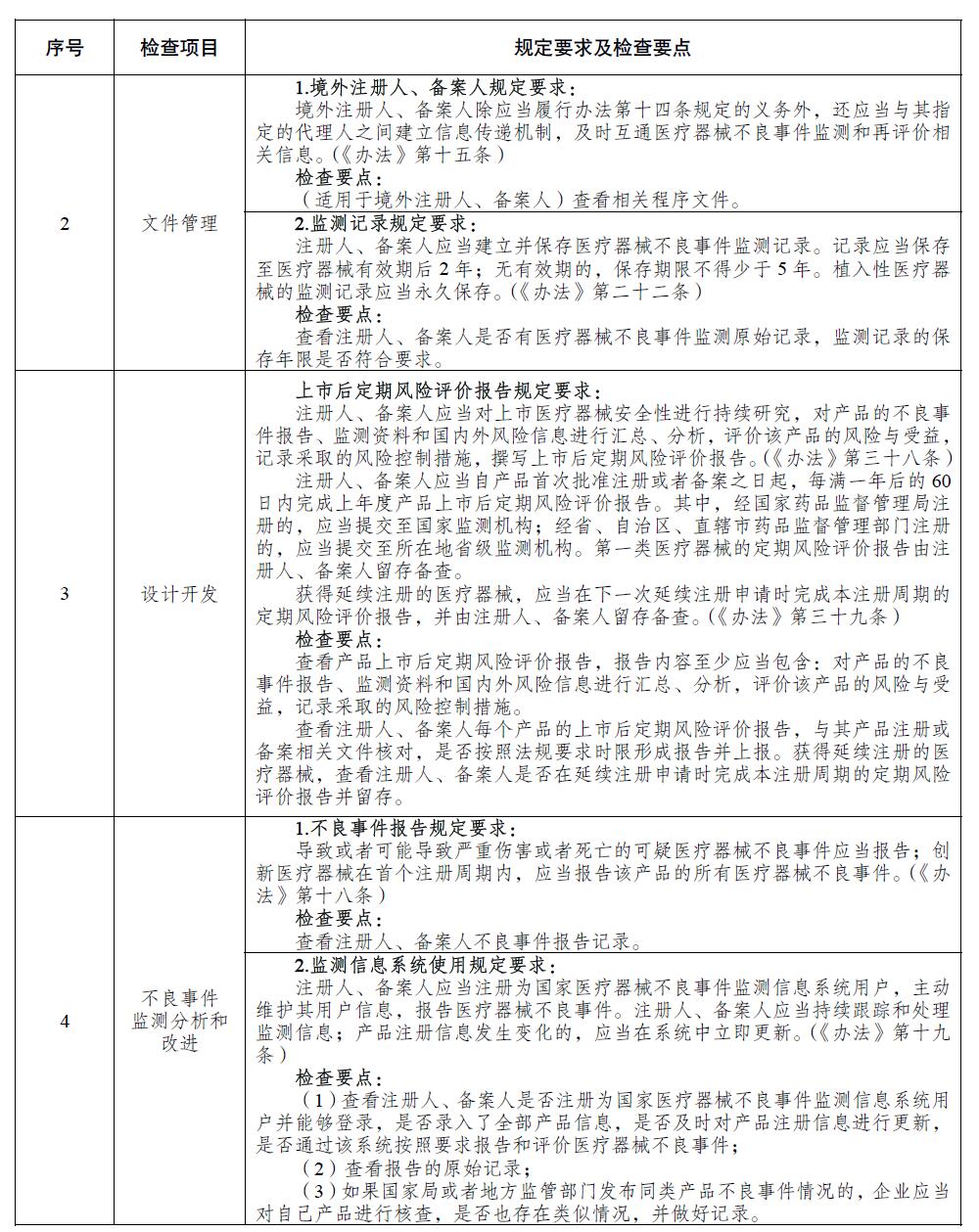
为贯彻实施《医疗器械不良事件监测和再评价管理办法》,落实医疗器械注册人备案人主体责任,加强医疗器械不良事件监测检查工作,国家药监局组织制定了《医疗器械注册人备案人开展不良事件监测工作检查要点》,以规范和指导对医疗器械注册人备案人的质量管理体系检查、不良事件监测专项检查、日常监督检查等工作。现印发你们,请结合工作实际贯彻执行。
附件:医疗器械注册人备案人开展不良事件监测工作检查要点
国家药监局综合司
2021年4月6日
附件:



《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:宋佳薇)
分享至
×
右键点击另存二维码!
网民评论
欢迎
登录
-
为你推荐
-

代表委员议国是 | 张伯礼代表:从源头提高中药质量
在今年全国两会上,全国人大代表、中国工程院院士、中国中医科学院名誉院长张伯礼建议,从源头提升中药质量,助力产业可持续发展。 2026-03-06 14:14 -

互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有