政策+资本双轮驱动 License out量价齐增
- 2021-08-30 18:14
- 作者:冯玉浩
- 来源:中国食品药品网
根据不完全统计,2020年1月至2021年8月,国内创新药对外授权合作(License out)项目达到39个,其中仅2020年,License out项目就已超过去五年之和;2021年License out依旧火热,截至8月底,国内医药企业又有14个品种成功出海,超2019年国内医药企业全年License out之和。受益于政策和资本的共同推动,我国License out数量快速增长,License out价格再创新高。
License out呈现新趋势
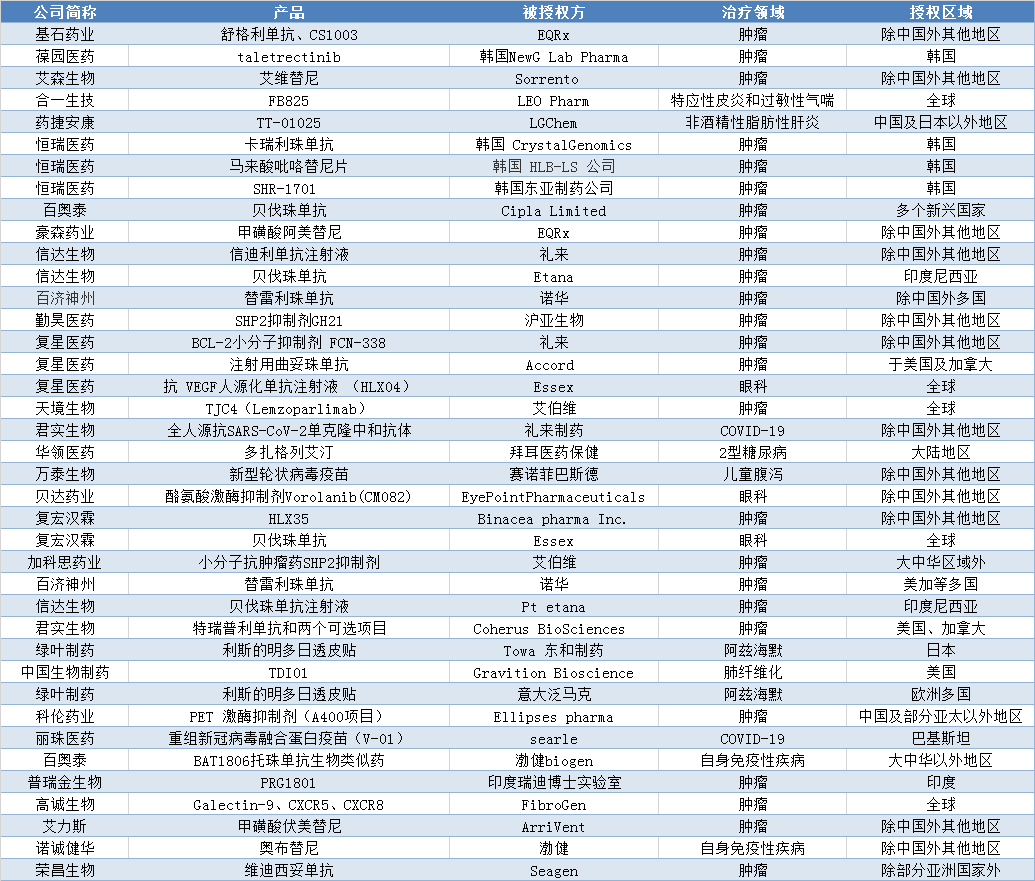
我国药物License out呈现新趋势。适应症更加多样,眼科类、疫苗类、神经退行性疾病类专利产品相继进入国际市场;更多企业参与其中,未盈利的上市药企也通过授权合作来回笼资金、补充研发;被授权方更加多元,形成了跨国药企和区域性医药企业共同参与的新格局(见表1)。
2020-2021.8.30 License out项目不完全统计
来源:公开资料统计
适应症更加多样。在过去的License out项目中,抗肿瘤类药物占据绝对多数;2020年后,其他适应症逐渐增加。如针对2型糖尿病的国产创新药多扎格列艾汀、万泰生物的新型轮状病毒疫苗,中国生物制药的治疗肺部纤维化创新药TDI01等。
License out成为未盈利的生物技术公司回笼资金、补充研发的又一途径。如百奥泰、信达生物、君实生物等公司都采用对外授权合作的方式来回笼资金。2020年,信达生物研发支出较上年增加43%,亏损较上年减少42.0%,这受益于公司和Etana、礼来制药签订的授权合同,仅授权费及服务一项就为公司创造了14.76亿元的收入。2020年君实生物与礼来制药就全人源抗SARS-CoV-2单克隆中和抗体达成授权协议,仅技术许可一项为君实生物创收4.05亿元,约占其主营业务收入的四分之一,为该公司上涨八成的研发费用提供了保障;2021年2月,君实生物就特瑞普利单抗和两个可选项目在美国、加拿大的独占权利和Coherus达成协议,为此将获得最高可达11.1亿美元的相关款项,此收入将为公司后续研发提供保障。
授权对象更加丰富。过去,国内创新企业License out的合作对象大多为跨国药企,如阿斯利康、默克集团、礼来制药、默沙东等。但2020年以来,越来越多的区域性药企成为新的合作对象,如意大泛马克、美国初创药企EQRx等等。
同时,授权区域也逐渐细化。如丽珠医药就V-01与巴基斯坦的Searle公司达成合作,相关产品进入巴基斯坦;恒瑞医药的卡瑞利珠单抗、马来酸吡咯替尼片、SHR-1701分别授权给韩国Crystal Genomics、HLB-LS以及东亚制药;瑞普金生物的PRG1801授权给了瑞迪博士实验室,进入印度市场。由此可见,越来越多的授权项目向更细分的市场渗透。
License out价格不断走高。8月9日荣昌生物发布公告,将自主研发的抗HER2抗体偶联药物(ADC)维迪西妥单抗的除部分亚洲国家外的开发和商业化权利授予美国生物制药企业Seagen,此次交易包含了2亿美元的首付款,24亿美元的里程碑款,以及销售净额提成。一举刷新了不到一年前,由天境生物抗肿瘤药物CD47单抗lemzoparlimab创下的19.4亿美元的授权款项记录。
政策+资本双轮驱动,医药创新厚积薄发
审评审批制度改革不断深化,药物创新迎来发展新机遇。2015年国务院发布《关于改革药品医疗器械审评审批制度的意见》,2017年中办国办发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,这两份文件对医药创新发展,起到了统领全局的作用,文件多次强调要对新药和创新医疗器械给予优先审评审批。与药品相关的职能部门也纷纷出台政策措施,促进医药行业创新发展。
2020年7月开始实施的新修订《药品注册管理办法》中特别增设药品加快上市注册程序一章,设立突破性治疗药物、附条件批准、优先审评审批、特别审批四个通道,支持以临床价值为导向的药物创新。2020年7月8日,随着《突破性治疗药物审评工作程序(试行)》《药品附条件批准上市申请审评审批工作程序(试行)》《药品上市许可优先审评审批工作程序(试行)》三个重磅文件的发布,和《国家食品药品监督管理局药品特别审批程序》一道,开启了新药上市的四条“高速公路”,药品审批大幅提速,药企创新意愿大大加强。
国家药监部门加入ICH(国际人用药品注册技术协调会),我国药品注册领域与国际接轨,药品监管部门、制药行业和研发机构逐步采取和实施国际药品领域的高标准,引入全球通行的药物研发与注册技术要求。这一方面提升了国内制药行业创新力、竞争力,另一方面也有利于中国制药融入国际医药产业链,中国药品进入国际市场。
此外,财政部、科技部、国家医疗保障局等多部门也纷纷出台政策,推动创新药产业高质量发展。比如医保制度改革实现“腾笼换鸟”,促进创新药可及性提高。医保目录实现一年一次的动态调整,使创新药能够及时纳入医保。在不久前公布的《2021年国家医保药品目录调整通过初步形式审查的申报药品名单》中,部分今年刚刚获批上市的创新药已经被纳入初审名单,其中包含阿伐替尼片、CAR-T产品阿基仑赛注射液等。创新药进入医保速度大幅提升,可帮助创新药企加速回笼资金,是对医药创新的有力推动。
资本市场助力优质创新企业成长
新药研发存在着“资金投入大、研发周期长、市场风险高”等多重挑战。行业常以“十年十亿美元”描述新药研发所面临的漫长时间和庞大投入。审评审批制度改革大大缩短了国内创新药的研发周期,资本市场也降低上市门槛,为医药创新提供资金保障。
上海证券交易所发布的科创板股票上市规则中,为了支持和鼓励具备研发实力的医药企业在科创板上市,对医药企业放宽了财务指标方面的限制,不再设置营业收入要求;香港联合交易所发布的《新主板上市规则》允许尚未盈利或未有收入的生物科技公司申请香港主板上市。上交所和联交所为缺乏资金且有创新能力的生物科技公司降低了上市门槛,创新药公司迅速得到了资本的青睐与支持。
以生物制药领域为例,刚刚刷新了License out交易金额的荣昌生物,仅2020年就通过发行股票融资37.72亿元。2020年该公司的研发支出进一步增加到4.66亿元,较上年增加了32.29%,融资所得为公司的研发增长提供了物质保障。信达生物更是在2020年通过了三轮新股配售方案,成功筹集13亿美元资金。公司年报显示,多轮配售后的信达生物拥有现金18亿美元,资金储备为公司药物研发、潜在业务合作、生产设施扩展等提供了强大支持。
根据药审中心发布的数据显示,仅今年上半年,我国1类创新药的批准数量达到破纪录的21个,超过2020年全年通过的创新药数量。随着鼓励创新政策的不断推出,药审改革红利的持续释放和资金对生物医药领域的持续支持,我国创新药在未来将会继续涌现,而创新药物也将乘东风出海,方兴未艾。(冯玉浩)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐
-

2021年9月第二周创新药周报
2021年9月第二周,陆港两药地创新板块共计18支个股上涨,23支个股下跌。其中涨幅前三为康宁杰瑞制药-B(+9.74%)、百奥泰-U(+9.28%)、华领医药-B(+6.67%)。跌幅前三为开拓药业-B(-9.74%... 2021-09-13 09:47 -
澳华即将上市,内镜市场前景如何?
2021年8月18日上海澳华内镜股份有限公司(简称“澳华内镜”)科创板IPO已提交注册,拟募资6.4亿元。我们看到我国内窥镜行业众多公司陆续崭露头角,在我国消化系统疾病频发的现状下,内镜市场前... 2021-09-13 09:45
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有