观点|中国药品试验数据保护制度亟待建立
- 2021-09-07 10:51
- 作者:王海燕
- 来源:中国食品药品网
药品试验数据保护制度,是指在一定数据保护期内原研药公司可以对药品试验数据享有独占权,从而鼓励创新药研发的一种制度。药品试验数据保护在促进药品创新,提高创新药物的可及性,满足临床用药需求方面起到了积极作用。
中国药品试验数据保护制度沿革
中国的药品数据保护制度要追溯至1993年,世界贸易组织(WTO)框架下的《与贸易有关的知识产权协议》(TRIPS协议)首次从国际法层面要求各WTO成员国对未披露的药品试验数据提供最低保护标准。为加入WTO,2002年1月国务院公开的《中国加入工作组报告书》(以下简称《报告书》)第284条中承诺:为遵守《TRIPS协定》第39条第3款,中国将对为申请使用新化学成份的药品或农业化学品的销售许可而按要求提交中国主管机关的未披露试验数据或其他数据提供有效保护,以防止不正当商业利用,但披露这些数据是保护公共利益所必需的或已采取保护措施防止该数据受到不正当商业利用的情况除外。这种保护包括,采用并制定法律和法规,以保证自中国政府向数据提供者授予销售许可之日起至少6年内,除数据提供者外,未经数据提供者允许,任何人不得以该数据为基础申请产品销售许可。在此期间,对于任何第二个申请销售许可的人,只有当其提交自己的数据时方可被授予销售许可。所有使用新化学成分的药品或农业化学物质均可受到此种数据保护,无论其是否受专利保护。
2002年8月12日颁布的《药品管理法实施条例》对《报告书》中相应内容予以制度化。《药品管理法实施条例》第三十五条中规定:国家对获得生产或者销售含有新型化学成分药品许可的生产者或者销售者提交的自行取得且未披露的试验数据和其他数据实施保护,任何人不得对该未披露的试验数据和其他数据进行不正当的商业利用。自药品生产者或者销售者获得生产、销售新型化学成分药品的许可证明文件之日起6年内,对其他申请人未经已获得许可的申请人同意,使用前款数据申请生产、销售新型化学成分药品许可的,药品监督管理部门不予许可;但是,其他申请人提交自行取得数据的除外。除下列情形外,药品监督管理部门不得披露本条第一款规定的数据:1.公共利益需要;2.已采取措施确保该类数据不会被不正当地进行商业利用。
2007年10月1日起施行的《药品注册管理办法》第20条固化了该项规定,明确:按照《药品管理法实施条例》第三十五条的规定,对获得生产或者销售含有新型化学成分药品许可的生产者或者销售者提交的自行取得且未披露的试验数据和其他数据,国家食品药品监督管理局自批准该许可之日起6年内,对未经已获得许可的申请人同意,使用其未披露数据的申请不予批准;但是申请人提交自行取得数据的除外。
2016年6月1日发布的《药品管理法实施条例》修订版第34条仍保留该项规定,内容同2002年《药品管理法实施条例》第35条。
2017年5月12日,原国家食品药品监管总局公开征求《关于鼓励药品医疗器械创新保护创新者权益的相关政策(征求意见稿)》(2017年第55号公告),其中明确完善药品试验数据保护制度,规定:申请人在提交药品上市申请时,可同时提交试验数据保护申请。对批准上市的创新药,给予6年数据保护期;既属于创新药又属于罕见病用药、儿童专用药,给予10年数据保护期;属于改良型新药的罕见病用药、儿童专用药,给予3年数据保护期;属于创新的治疗用生物制品,给予10年数据保护期。挑战专利成功和境外已上市但境内首仿上市的药品,给予1.5年数据保护期。在欧洲、美国和日本获准上市后1年内在中国提出上市申请和数据保护的新药,给予相应类别数据保护期;超过1年到中国提出上市申请的,按超出时间扣减数据保护期时间;扣除后不足1.5年的,给予1.5年数据保护期。数据保护期自药品批准上市之日算起。在数据保护期内,审评机构不再批准其他申请人同品种上市申请,申请人自行取得的数据除外。
2017年10月8日印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(以下简称《意见》)中明确,完善和落实药品试验数据保护制度。药品注册申请人在提交注册申请时,可同时提交试验数据保护申请。对创新药、罕见病治疗药品、儿童专用药、创新治疗用生物制品以及挑战专利成功药品注册申请人提交的自行取得且未披露的试验数据和其他数据,给予一定的数据保护期。数据保护期自药品批准上市之日起计算。数据保护期内,不批准其他申请人同品种上市申请,申请人自行取得的数据或获得上市许可的申请人同意的除外。
为落实《意见》要求,完善药品数据保护制度,促进药品创新,提高创新药物的可及性,国家药品监督管理局组织起草了《药品试验数据保护实施办法(暂行)(征求意见稿)》(以下简称《征求意见稿》),并于2018年4月26日向社会公开征求意见。《征求意见稿》提出,药品试验数据的实施主体、保护对象、受保护的数据范围及要件、保护方式与期限以及实施流程等。同时提出:对创新药、创新治疗用生物制品、罕见病治疗药品、儿童专用药、专利挑战成功的药品,对申请人基于自行取得的试验数据获得上市许可的,给予一定数据保护期限。受保护的数据范围为:药品上市申请人根据要求所提交的药品上市注册申请文件数据包中与药品有效性相关的非临床和临床试验数据,但是与药品安全性相关的数据除外,并应满足以下条件:1.以获得药品上市许可为目的提交药品注册申请资料中所要求提交的数据;2.提交药品注册申请前未公开披露;3.未依赖他人的试验数据或已公开发布的研究成果自行取得。针对上述保护范围的同一药品先后授予的各项保护期,采用独立运行原则,分别按照相应药品注册申请自被批准之日起分别计算。明确保护方式为:在保护期内,未经数据保护权利人同意,国家药品监督管理部门不得批准其他申请人同品种药品上市申请,但申请人依赖自行取得的试验数据或获得上市许可的申请人同意的除外。征求意见稿中同时对防止权力滥用做出了限制性要求:取得数据保护的权利人应在取得权利之日起主动披露其被保护的数据。同时要求,取得数据保护的药品自批准上市之日起1年内由于自身原因未在市场销售的,则该保护期经有关利益相关方向国家药品监督管理部门提出撤销申请,经核实情况属实的,该数据保护应被撤销。
药品试验数据保护相关制度尚待明确
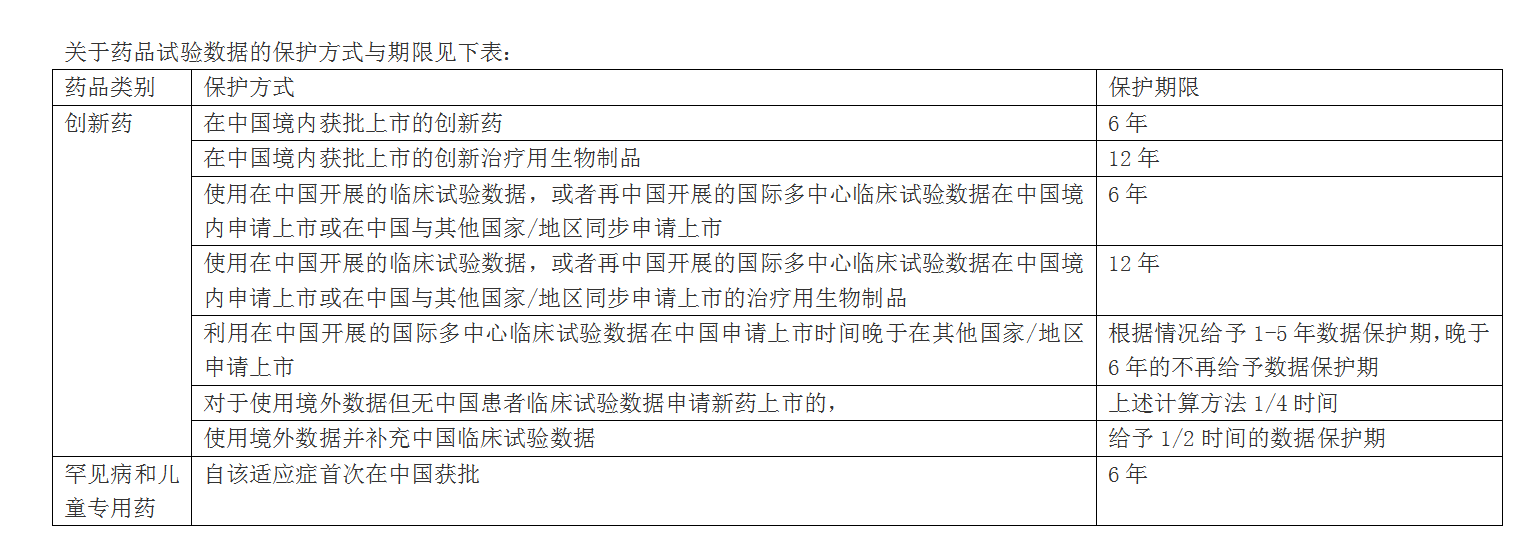
《征求意见稿》中药品试验数据的保护期限与2017年第55号公告征求意见稿中内容相比,保护时限上做了调整。对于专利挑战成功的药品,征求意见稿中未予明确保护期限。
关于药品试验数据的保护方式与期限见下表:
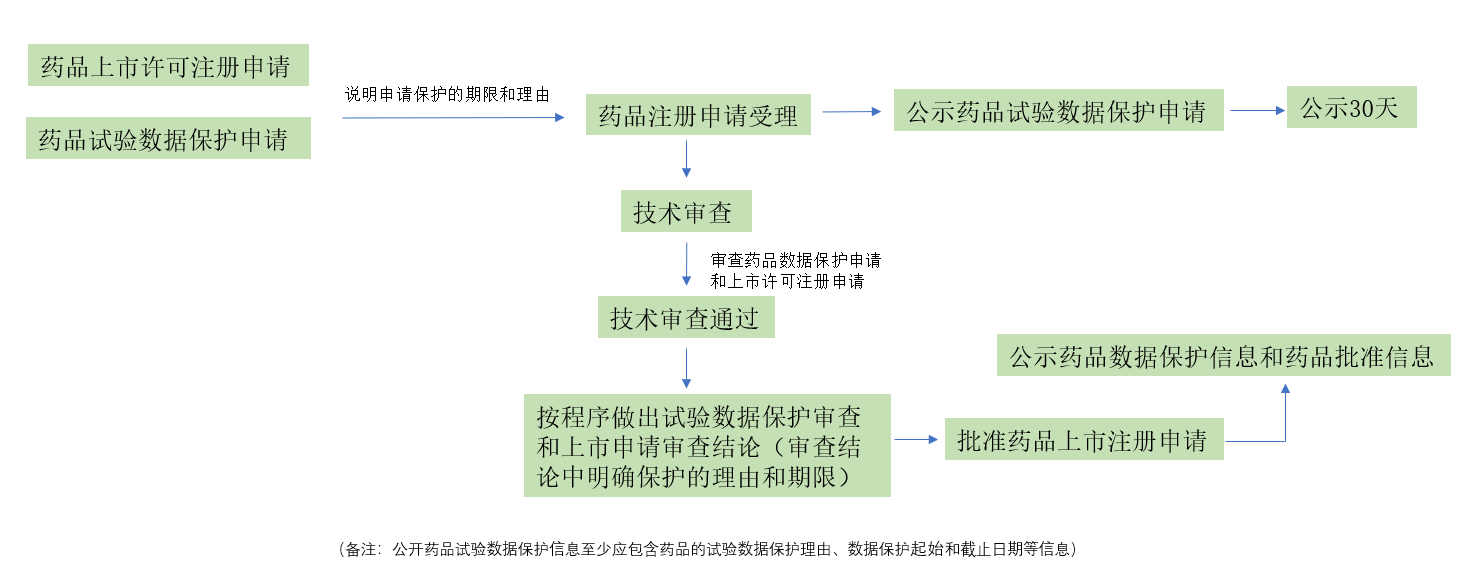
关于药品试验数据保护的实施流程,《征求意见稿》中提出,药品试验数据保护申请需要和药品上市许可申请同时提交,并随后经过受理公示、技术审查以及公示授权等后续流程。具体流程如下图:
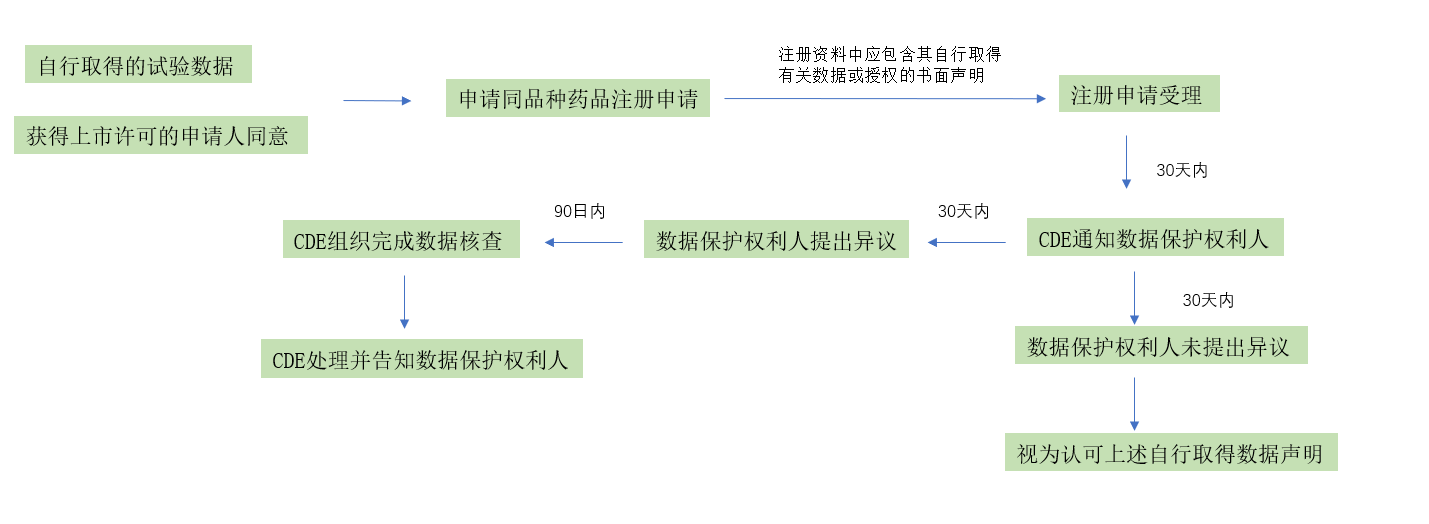
对于保护期内同品种上市申请,《征求意见稿》提出的药品试验数据保护相关流程如下:
2019年新版《药品管理法》和2020年新版《药品注册管理办法》取消了新药监测期制度。但关于我国药品试验数据保护的相关制度尚未正式落地,具体执行情况仍待监管部门发文予以明确。(恒瑞医药临床医学二部 王海燕)
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐
-

剖析法条明要素 靶向发力寻证据 ——浅析证明对象在药品行政处罚中的应用
如何运用证明对象的概念指导药品行政执法部门正确收集证据、认定案件事实并准确适用法律呢?笔者认为,可分解法律条文中规定的药品违法行为的构成要件,明确各构成要素,并将这些要素作为证明对... 2025-12-16 08:45 -

企业捐赠的医疗器械质量不合格,如何处罚?
A省药监局查处一起医疗器械生产企业生产的医用外科口罩不符合强制性标准案。该案中,B企业生产的不合格产品一部分用于销售,另有70%的产品捐赠至社会单位。 这并非个案。此类案件争议的焦点集中... 2025-12-16 08:50
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有