GVP逐条谈 | 80.今年的定期安全性报告,你还会爱答不理吗?
- 2021-09-14 16:44
- 作者: 马明媛
- 来源:中国食品药品网
【条文】
《药物警戒质量管理规范》第五章 风险识别与评估
第四节 定期安全性更新报告
第八十条 创新药和改良型新药应当自取得批准证明文件之日起每满1年提交一次定期安全性更新报告,直至首次再注册,之后每5年报告一次。其他类别的药品,一般应当自取得批准证明文件之日起每5年报告一次。药品监督管理部门或药品不良反应监测机构另有要求的,应当按照要求提交。
【理解】
第八十条规定了需要提交定期安全性报告的药品种类和提交时间。
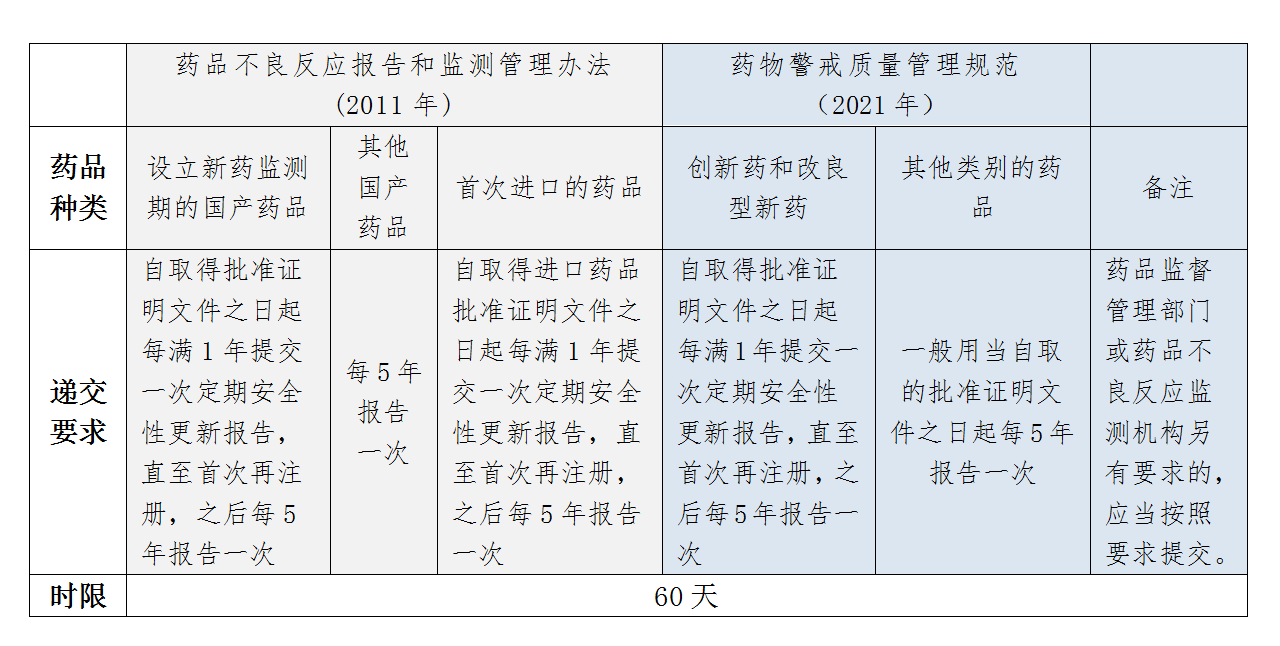
《药物警戒质量管理规范》自2021年12月1日起正式施行。原卫生部制定的《药品不良反应报告和监测管理办法》与《药物警戒质量管理规范》(GVP)中对于PSUR报告(药品定期安全性更新报告)的递交周期要求如下图:
可以看出,两个法规对于PSUR递交周期的规定不同:前者以新药监测期为分界点;而GVP淡化了新药监测期的概念,强调了PSUR的报告周期根据药品注册分类而改变,因此持有人需要根据药品种类按要求提交PSUR。
·创新药与改良型新药的定义
创新药:指含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品。
改良型新药:在已知活性成分的基础上,对其结构、剂型、给药途径、适应症等进行优化,且具有明显临床优势的药品。结构优化是指含有用拆分或者合成等方法制得的已知活性成份的光学异构体,或者对已知活性成份成酯,或者对已知活性成份成盐(包括含有氢键或配位键的盐),或者改变已知盐类活性成份的酸根、碱基或金属元素,或者形成其他非共价键衍生物(如络合物、螯合物或包合物)等等。
·哪些产品不需要提交PSUR?
1. 原料药、辅料、体外诊断试剂,不需要提交PSUR;
2. 中药材、中药饮片以及进口中药材,不需要提交PSUR;
3. 境内药品生产企业接受境外委托生产(如通过欧盟/FDA等相关国家/地区认证,符合委托国法律法规),但是未在我国上市的产品,不需要提交PSUR。
·按法规要求每5年提交一次PSUR的产品,是否可以在第5年一次性提交5份1年期的PSUR?
不可以。
根据《药品定期安全性更新报告撰写规范》要求,制药企业应以取得药品批准证明文件的日期(CBD)为起点计,撰写PSUR。
如果公司统一的PSUR撰写频率高于我国现行法规要求,依据公司统一的PSUR撰写频率进行提交。可以提交以国际诞生日(IBD)为起点计的PSUR,且应在第一次提交PSUR时补充IBD和CBD时间间隔内的数据并进行分析,之后保持PSUR数据覆盖时间连续。
不接受一次提交多份PSUR的报告方式。如果公司统一的PSUR撰写频率低于我国《药品定期安全性更新报告撰写规范》,应提交符合我国要求撰写的PSUR。
【实践影响】
不同药品种类的PSUR报告周期不同,持有人需要详细了解并按时提交,以防遗漏。
【延伸阅读】
提交定期安全性报告(PSUR)的重要性
《药品不良反应报告和监测管理办法》 第五十八条
(浙江太美医疗科技股份有限公司医学专员 马明媛)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐
-

“老药丸”交易法律责任探析
关于“老药丸”的法律属性以及售卖行为是否正当,当前执法层面存在争议:一是“老药丸”是否具备收藏品属性,能否合法纳入收藏品交易范畴;二是此类变相售卖行为,是否已触及违法乃至犯罪的法律... 2025-12-02 09:03 -

关于有源医疗器械使用期限的探讨
近期,有源医疗器械使用期限成为热点话题。有源医疗器械使用期限从何时开始计算?已超出说明书及标签标示使用期限的有源医疗器械能否继续使用?业内对此存在不同看法。 2025-11-11 16:19
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有