每周医药看点(9.24-10.7)
- 2021-10-08 14:56
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 国务院办公厅印发《“十四五”全民医疗保障规划》;《体外诊断试剂临床试验技术指导原则》《医疗器械临床评价技术指导原则》等文件发布;芦荟珍珠胶囊由处方药转化为非处方药……9月24日-10月7日,医药行业的这些事情值得关注。
行业政策动态
1.国务院办公厅印发《“十四五”全民医疗保障规划》,涉及15个指标,包括参保覆盖率、基金安全、保障程度、精细管理和优质服务。规划提出,健全多层次医疗保障制度体系,提升基本医疗保险参保质量,优化完善基本医保待遇保障和筹资机制,鼓励商业健康保险和医疗互助发展,稳步建立长期护理保险制度;优化医疗保障协同治理体系,完善医疗保障支付机制和医药价格形成机制,加快健全基金监管体制机制,协同建设高效的医药服务供给体系;构筑坚实的医疗保障服务支撑体系,健全医疗保障公共服务体系,强化法治支撑,推动安全发展,加快医保信息化建设,健全标准化体系。
2.国家药监局正式致函药品检查合作计划(PIC/S),申请启动预加入程序。预加入程序是加入PIC/S的一个步骤,旨在帮助申请者在提出正式申请前更好地理解PIC/S的相关要求。
3.国家药监局发布《免于临床试验的体外诊断试剂临床评价技术指导原则》,为申请人对免于临床试验的体外诊断试剂临床评价提供技术指导,同时为药品监督管理部门对该部分资料的技术审评提供参考依据。
4.国家药监局发布《体外诊断试剂临床试验技术指导原则》,明确体外诊断试剂临床试验的基本原则和临床试验中需要考虑的关键因素,并对临床试验质量管理提出基本要求,以指导申办者的临床试验工作,为技术审评部门对临床试验资料的审评提供参考。
5.国家药监局发布《医疗器械临床评价技术指导原则》《决策是否开展医疗器械临床试验技术指导原则》《医疗器械临床评价等同性论证技术指导原则》《医疗器械注册申报临床评价报告技术指导原则》和《列入免于临床评价医疗器械目录产品对比说明技术指导原则》5项医疗器械临床评价相关技术指导原则,为注册申请人开展医疗器械产品注册工作和药品监管部门进行技术审评提供指导。
6.国家药监局发布通告,新修订《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》自今年10月1日起施行。根据通告,两个办法实施前已受理但尚未作出审批决定的注册申请项目,药品监督管理部门按照原规定继续审评审批,符合上市条件的,颁发医疗器械注册证。两个办法实施前已受理但尚未作出审批决定的注册申请项目,如补正材料涉及检验报告,注册申请人应当委托具有资质的医疗器械检验机构出具补充检验报告;如注册申请人的体系核查涵盖了检验能力,也可以按照两个办法及相关要求提交补充自检报告。
7.国家药监局根据《医疗器械监督管理条例》和《医疗器械注册与备案管理办法》,组织制定了《医疗器械注册申报资料和批准证明文件格式要求》《医疗器械注册申报资料要求及说明》《医疗器械延续注册申报资料要求及说明》《医疗器械变更备案/变更注册申报资料要求及说明》《医疗器械临床试验审批申报资料要求及说明》和《医疗器械安全和性能基本原则清单》等6份申报资料要求和批准证明文件格式要求,同时发布了《中华人民共和国医疗器械注册证(格式)》《国家药品监督管理局医疗器械临床试验审批意见单(格式)》等3份医疗器械相关格式示例。
8.国家药监局发布公告,自2021年12月29日起,化学药品注册分类1类、5.1类,以及治疗用生物制品1类和预防用生物制品1类的上市许可申请,可按照药品电子通用技术文档(eCTD)进行申报。
9.国家药监局再次就《化妆品不良反应监测管理办法(征求意见稿)》公开征求意见。本次征求意见稿进一步明确了化妆品注册人、备案人不良反应监测的主体责任,不良反应分级分类管理原则,各级化妆品不良反应监测机构的职责分工和工作要求,完善不良反应风险信号调查处置要求。
10、国家药监局发布公告称,国内已上市的顺铂注射剂、注射用异环磷酰胺、硫唑嘌呤片、注射用门冬酰胺酶和注射用硫酸长春地辛5个抗肿瘤药品相应规格可以参照公告要求,递交修订说明书的补充申请,增补儿童用药信息。
11.国家药监局发布公告,将芦荟珍珠胶囊(每粒装0.5克)由处方药转化为非处方药,并发布品种名单及非处方药说明书范本。
12.CDE就《口服固体制剂混合均匀度和中控剂量单位均匀度研究技术指导原则(征求意见稿)》《化学仿制药晶型研究技术指导原则(征求意见稿)》《对我国<以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则>中关于多规格豁免BE药学评价标准“处方比例相似性”相关问题的问答(征求意见稿二)》公开征求意见,征求意见截止日期为2021年10月25日;就《特立帕肽注射液生物类似药临床试验设计指导原则(征求意见稿)》公开征求意见,征求意见截止日期为2021年10月29日。
产品研发/上市信息
1.国家药监局批准惠州海卓科赛医疗有限公司生产的创新产品“水动力治疗设备”和“一次性使用清创水动力刀头”注册申请。水动力治疗设备由主机、脚踏开关、废液桶、电源线、接地线构成;一次性使用清创水动力刀头由输液管组件、高压管、废液管组件、泵体及手柄组件组成。两个产品配合使用,预期用于伤口清创(急性和慢性伤口、烧伤)、软组织清创。该产品为首个利用高压水动力进行清创治疗的国产产品,为国内首创。
2.国家药监局发布3期药品批准证明文件待领信息,共包括257个受理号,涉及山东鲁抗医药股份有限公司等企业。(截至10月7日)

3.国家药监局发布6期医疗器械批准证明文件(准产)待领信息,共包括144个受理号,涉及中山大学达安基因股份有限公司等企业。(截至10月7日)

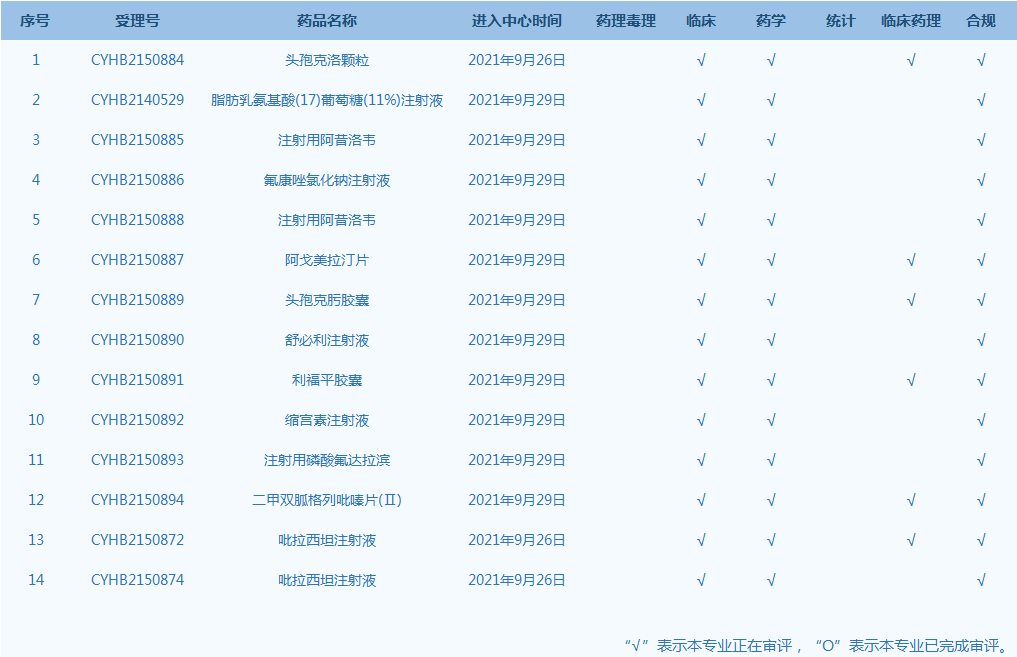
4.CDE网站公示14个仿制药一致性评价任务,涉及头孢克洛颗粒等药品。(截至10月7日)
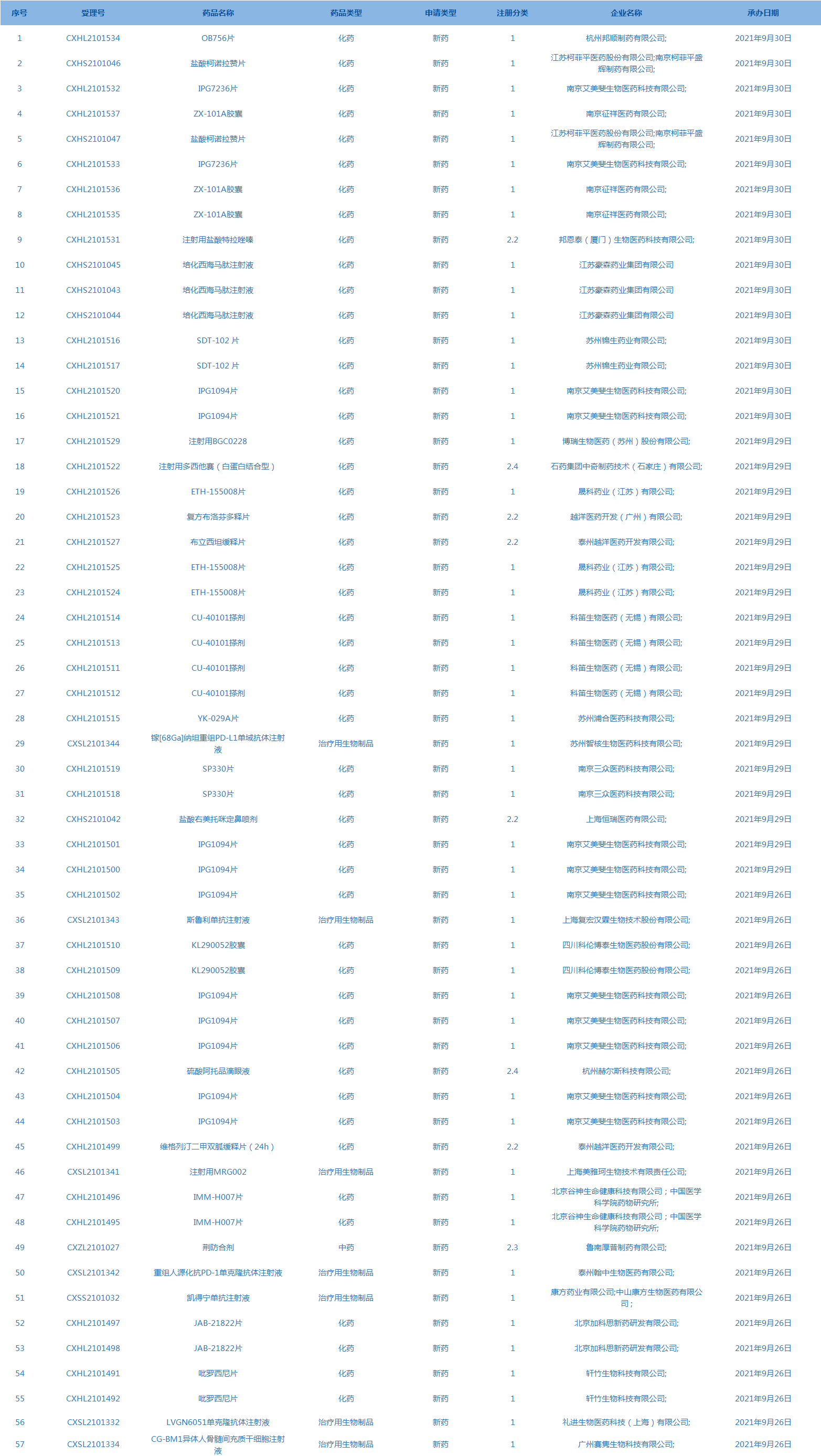
5.CDE承办受理57个新药上市申请,包括盐酸柯诺拉赞片等药品。(截至10月7日)
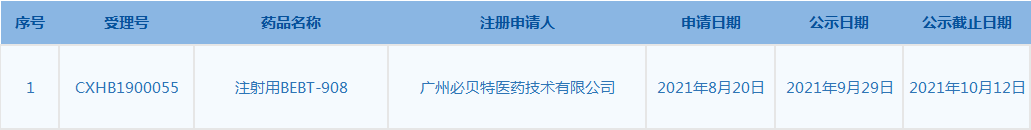
6.CDE网站信息显示,注射用BEBT-908被列入拟突破性治疗品种。(截至10月7日)
医药企业观察
1.恒瑞医药发布公告称,收到美国FDA关于同意注射用SHR-A1904治疗晚期实体瘤临床研究的函,公司将于近期开展I/IIa期临床试验。
2.信达生物与UNIONtherapeutics共同宣布,双方就后者用于治疗炎症性皮肤病的主要候选药物orismilast,达成在中国的独家授权协议。这是一款处于临床II期的潜在“best-in-class”PDE4抑制剂。根据协议,信达生物将获得orismilast在中国研究、开发和商业化的独家权益。UNION公司将收到2000万美元的首付款,并有权获得累计不超过2.47亿美元的里程碑付款,以及orismilast在中国年度销售净额的特许权使用费。
3.四环医药发布公告称,附属子公司轩竹生物与SignalChemLifesciences公司就AXL靶向抑制剂SLC-391在大中华区的开发和商业化权益签订合作及许可协议。根据协议,轩竹生物向SignalChem支付1300万美元首付款,SignalChem未来有资格获得包括开发、注册和商业化里程碑等付款以及分级销售分成。四环医药将获得SLC-391在大中华区独家肿瘤治疗领域各项适应症的研究、开发、生产及商业化权利。
4.奇正藏药计划在拉萨建设区域总部基地——德堂林家园项目,项目总投资拟为50,000万元人民币,该项目为集研发创新平台、企业文化展示、办公、藏医特色康复及健康管理、藏药材展示交易、专家及员工公寓为一体的基础设施建设,为公司自建自用项目。
5.轶诺药业宣布完成数千万美元B轮融资,本轮融资由上海生物医药基金领投,山蓝资本、提梁投资、华赛智康和尚实天信跟投,老股东张科领弋追加投资。
6.西比曼生物宣布,公司完成1.2亿美元的A轮融资,由阿斯利康中金医疗产业基金、红杉资本、云锋基金共同领投,新加坡政府投资公司(GIC)、泰福资本等老股东跟投。本轮融资将主要用于推进抗CD19/CD20双靶点CAR-T疗法——C-CAR039未来在中国和美国的临床研究,以及加速靶向BCMA的CAR-T疗法——C-CAR088针对多发性骨髓瘤的临床开展。
7.创胜集团于9月29日在港交所正式上市。该公司是一家集发现、研究、开发、制造及业务拓展能力为一体的临床阶段生物医药公司。公开信息显示,此次创胜集团在港交所上市,每股发行价为16港元,预计全球发售所得款项净额约为5.74亿港元,基石投资者有LAV、淡马锡、QIA、中国国有企业结构调整基金等。
药械集中采购
1.湖北省医药价格和招标采购管理服务网发布《中成药省际联盟集中带量采购公告(第1号)》,明确由湖北、河北、山西、内蒙古、辽宁、福建、江西、河南、湖南、海南、重庆、四川、贵州、西藏、陕西、甘肃、宁夏、新疆、新疆生产建设兵团等联盟地区委派代表组成中成药省际联盟联采办,代表各地区公立医疗机构(含军队医疗机构)及自愿参加的医保定点社会办医疗机构和定点药店实施中成药集中带量采购,由湖北省医保局承担联采办日常工作并负责具体实施。采购范围为临床使用量大、采购金额高、多家企业生产的中成药品。根据产品的功能主治、给药途径和成分,将此次采购药品划分为17个产品组,共计76个药品。
2.上海市医保局发布《关于进一步完善本市定点药店药品价格和中药饮片、配方颗粒“阳光采购”管理有关事项的通知》,对医保定点零售药店药品价格管理,定点医疗机构中药饮片及配方颗粒“阳光采购”管理等方面内容做了明确的规定。
3.江西省药品医用耗材集中采购联席会议办公室发布《赣粤豫鄂四省联盟药品带量采购文件(JX-YP2021-01)》,涉及10个品种36个品规,并公布了首年约定采购量。联盟地区包括:江西、广东、河南、湖北,由江西省药品医用耗材集中采购联席会议办公室承担日常工作并具体实施。
4.广东省药品交易中心就《广东联盟双氯芬酸等153个药品集团带量采购文件(征求意见稿)》公开征求意见,涉及153个品种,包括血液制品3个、基础输液4个和其他药品146个,其中50个为独家品种(分组后)。
5.湖南公共资源交易中心发布《关于做好湖南省2021年抗菌药物专项集中采购相关药品补标及跟标工作的通知》。其中补标范围包括2021年度抗菌药物专项集采拟续约药品中不续约药品、2019年抗菌药物专项集采价格纠偏时第四质量层次弃标药品,共涉及13个品种。【中国食品药品网综合整理/刘思慧】
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐













