特应性皮炎治疗新时代,谁能脱颖而出
- 2021-10-11 13:45
- 作者:陈倩
- 来源:中国食品药品网
2021年9月21日,美国FDA批准了首款用于特应性皮炎(AD)治疗的JAK外用乳膏剂芦可替尼乳膏剂。自Dupilumab引领IL-4/13抑制剂在AD的开拓后,JAK抑制剂已全面加入轻中度和中重度AD治疗市场竞争,充分证明Th2通路在AD中是重要的致病因素。此外,仍有很多靶点在进行探索。特应性皮炎治疗已经步入新时代。
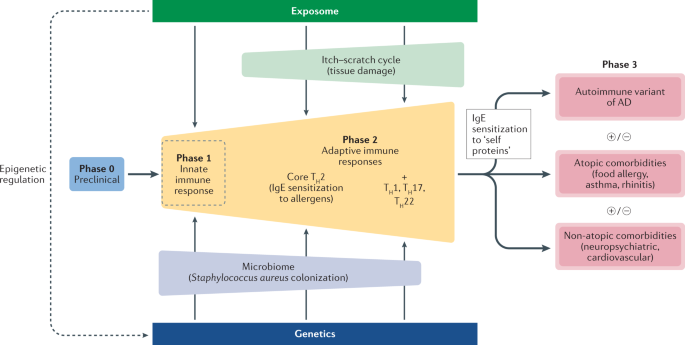
AD中的免疫发病机制
AD的免疫相关发病机制主要分为三个阶段,当表皮屏障因为干燥等原因被破坏后,第一个阶段由皮肤先天免疫被激活而开始;而后迅速激活第二个阶段——适应性免疫应答,这一阶段的核心为Th2活化并伴随着IgE因对过敏原敏感性增加而释放增加,而后Th1、 Th17和Th22等也相继应答增加而释放相应细胞因子,疾病变得更复杂;在免疫应答持续扩大后进入了第三个AD合并特应性疾病和非特应性疾病的阶段慢性发展时期,合并的特应性疾病包括食物过敏、哮喘和鼻炎,合并非特应性疾病包括炎症可能引起的动脉粥样硬化症的心血管疾病等。
Dupilumab开拓适应性免疫应答
目前很多新药开发集中在适应性免疫应答阶段,已经斩获包括6岁及以上青少年和成年AD人群的赛诺菲公司的Dupilumab(IL-4和IL-13抗体)是最好的证明。IL⁃4和IL⁃13是介导AD发病的重要细胞因子,目前正在开发6个月至6岁儿童AD人群。这一成功也开启了探索若仅靶向IL-4或IL-13,是否能更好地提高AD疗效的问题。
从作用机制上看,IL-4因可驱动Th2细胞分化而被认为处于更核心的位置,而IL-13在AD皮损皮肤中浓度更高,当AD皮损皮肤中IL-13过度表达会导致皮肤屏障的破坏、皮肤感染的风险增加、炎症进一步加剧、瘙痒,以及在慢性阶段重塑和皮肤增厚。
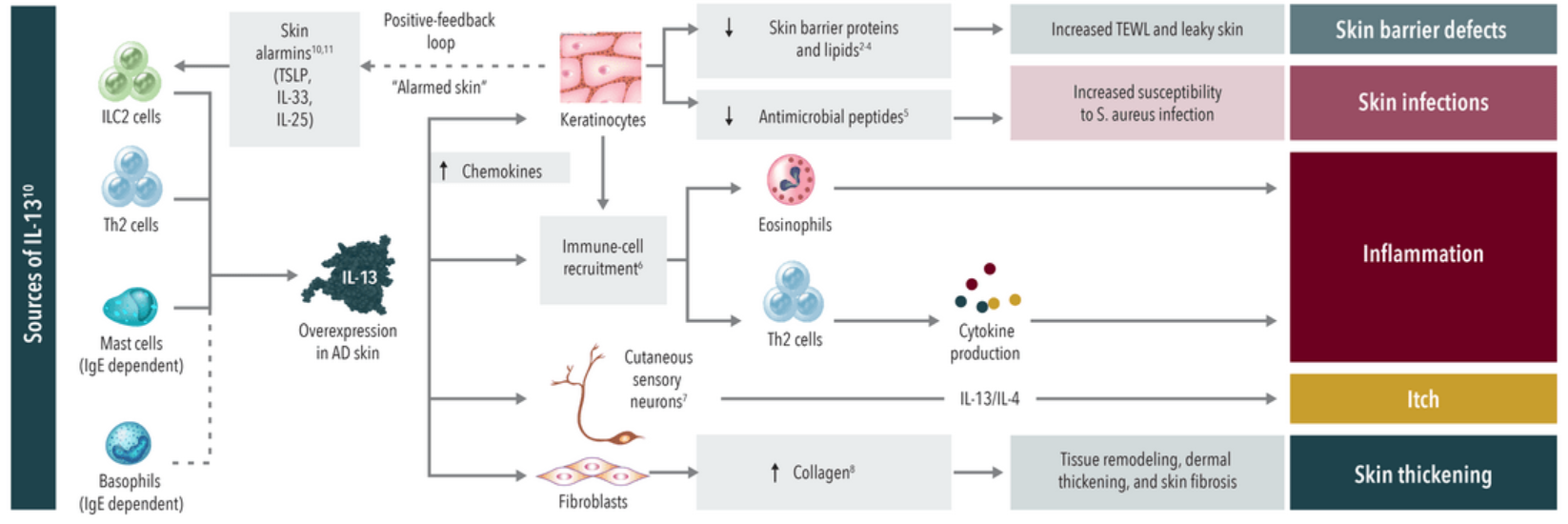
图 IL-13在AD受损皮肤中过表达的作用
康乃德的CBP-201是一种IL-4Rα拮抗剂,一项31名患者的Ib期研究结果显示,治疗4周后,在接受CBP-201的患者中,高达50%的患者观察到IGA 0/1,而安慰剂组为13%。EASI从基线的平均降低为74%,而安慰剂组为33%。虽然作用方式理论上与dupilumab相似,但似乎起效更快。
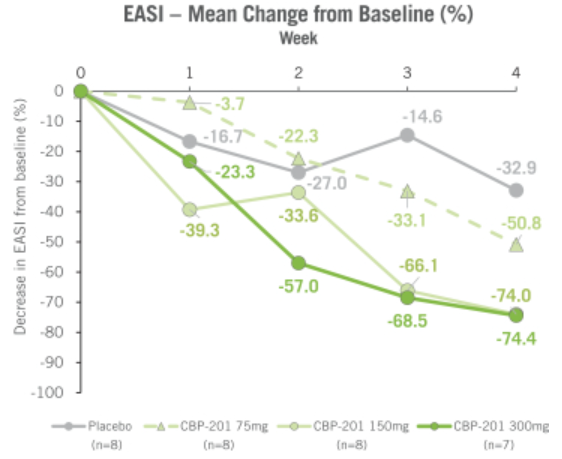
图 CBP-201的EASI较基线变化疗效数据
目前首款特异性靶向IL-13的抗体Tralokinumab已于今年7月获得欧盟批准上市。Tralokinumab是一种针对IL-13的全人源化抗体,阻断IL-13与IL-13Rα1和IL-13Rα2的结合。在III期关键单药治疗研究(ECZTRA 1和ECZTRA 2)中,在第16周时,tralokinumab(300mg皮下注射每2周1次)显示出优于安慰剂的效果,达到IGA0/1的比例为16%vs.7%(ECZTRA1)和22%vs.11% (ECZTRA2),达到EASI-75的比例为25%vs.13%(ECZTRA1)和33%vs.11%(ECZTRA2)。眼部不良事件(包括结膜炎、角结膜炎和角膜炎)是既往在dupilumab研究中特别关注的,在其关键研究中发生率为11%,在tralokinumab进行ECZTRA1和ECZTRA2研究中,16周眼部不良事件发生率为7.6%,而安慰剂组为3%,这些眼部不良事件可能主要与IL-13阻断活性有关,但也需要更长期的安全性数据来说明。
另一个靶向IL-13的抗体Lebrikizumab的两个关键III期试验ADvocate1和ADvocate2也报告达到16周EASI-75的主要终点,lebrikizumab的区别在于阻止IL-13Rα1/IL-4Rα异二聚体复合物的形成和信号传导,但不影响IL-13结合IL-13Rα2受体,这一特性是否影响安全和疗效数据需要等待具体数据公布。
这些靶向IL-4或IL-13的抗体涌入AD研发后,是否疗效或应答时间上优于dupilumab,且在dupilumab部分应答和无应答患者中有所作用,还需要时间来验证。
JAK抑制剂的广泛应用
JAK抑制剂在治疗AD方面的应用也是针对适应性免疫应答阶段相关细胞因子,目前JAK抑制剂口服和乳膏剂都能分别在中重度和轻中度AD人群中显出疗效,在口服JAK抑制剂中,从目前已经获得的III期临床试验结果可以看出,JAK1特异性抑制剂abrocitinib和upadacitinib已经完成了与dupilumab头对头的临床试验,就目前疗效而言,是dupilumab强有力的竞争者,也许可成为更优的选择,并且在JAK抑制剂中,这两个JAK1特异性抑制剂相对于JAK1/2抑制剂baricitinib也展现了更好的疗效,有讨论认为中重度AD由于皮损面积广泛,炎症影响范围比RA主要累及关节而言更广,所以baricitinib用于AD的疗效可能受限于剂量不够高。
芦可替尼乳膏剂治疗轻中度AD的关键性III期临床试验结果显示,治疗8周后0.75%BID和1.5%BID IGA-TS均能达到39%-53.5%,而安慰剂组仅为约7.6%-15.1%。这样的疗效结果显著优于另一个用于轻中度AD的PDE4抑制剂crisaborole,PDE4抑制剂在AD中的开发目前仅有乳膏剂,系统性PDE4抑制剂阿普司特已经被批准用于治疗中度至重度银屑病,而其在AD中的发展却没有进展。
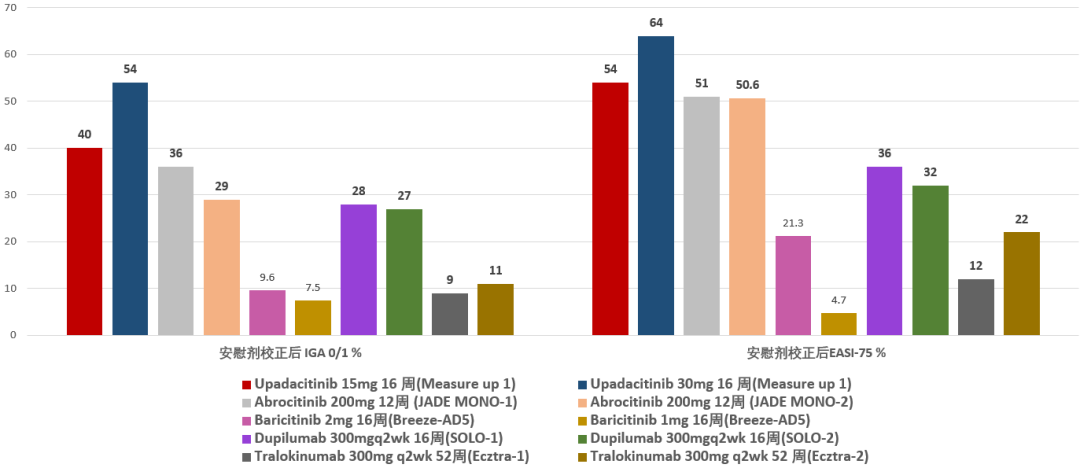
图 JAK抑制剂和IL-13抗体药物疗效比较
同时,JAK抑制剂也受到毒性的困扰。今年9月,美国FDA要求修订部分治疗慢性炎症的JAK抑制剂:托法替布、巴瑞替尼和upadacitinib加入黑框警告,以提示这些药物会提高癌症、血栓、严重心脏事件和死亡的风险。巴瑞替尼和upadacitinib尚未在类似的大型安全性临床试验中进行研究,因此尚未充分评估风险。但是,由于它们与托法替布具有相同的作用机制,因此FDA认为这些药物可能具有相似的风险。而市面上另外两种JAK抑制剂芦可替尼片剂和 fedratinib获批用于骨髓纤维化,不适用于治疗关节炎和其他炎症,因此不在此次要求增加风险警示之列。芦可替尼乳膏剂因是外用制剂,此次可能不会被要求加上黑框警告,但是目前FDA写明的使用方式为“短期,非连续使用”,还是会对患者选择造成影响。其实在外用钙调神经磷酸酶抑制剂中也有类似描述,但PDE4抑制剂crisaborole中并没有。
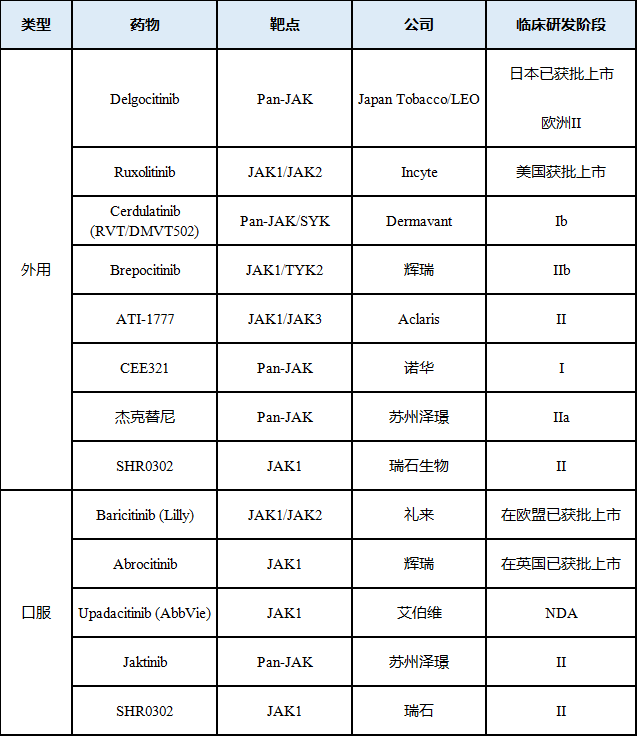
表1 目前临床用于开发AD的主要JAK抑制剂
Th2中及以外的探索
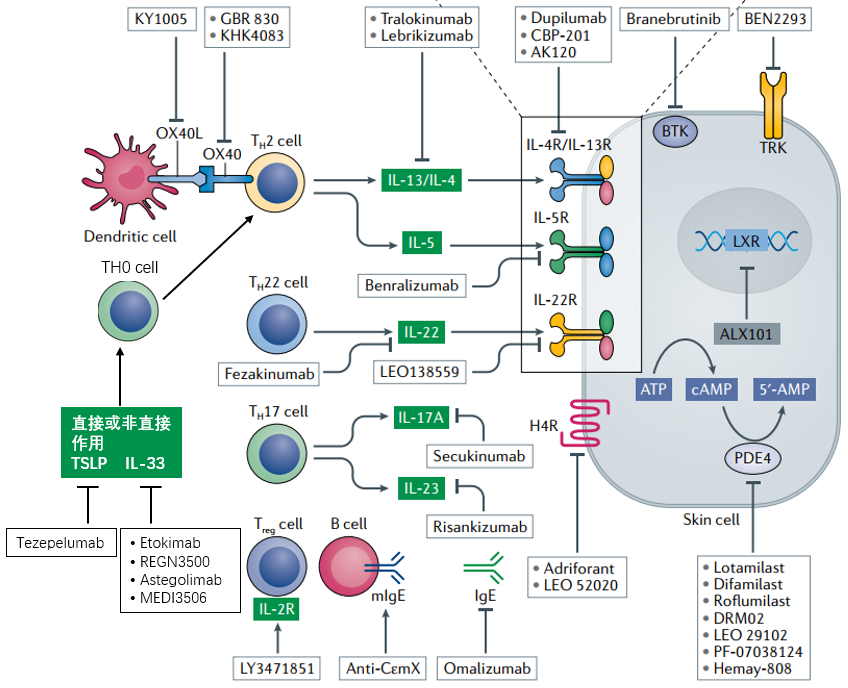
在Th2通路中的免疫球蛋白E(IgE)升高是AD诊断的关键因素之一。在绝大多数AD患者中可以看到,总IgE水平或至少一种过敏源特异性IgE显示阳性。奥马珠单抗是一种人源化单克隆抗体,能选择性地与IgE结合,抑制IgE与效应细胞表面高亲和力受体结合,阻止效应细胞活化脱颗粒、释放炎症因子及募集炎症细胞。在名为ADAPT的试验中发现,将奥马珠单抗用于血清总IgE高的AD儿童中,24周时SCORAD较基线下降了33%,最终疗效还需要在随机对照试验中再验证。
皮肤先天免疫反应阶段的上皮细胞衍生的危险信号介质胸腺基质淋巴细胞生成素(TSLP)和IL-33会协同直接或非直接刺激固有2型淋巴细胞(ILC2),进而激活Th2型细胞,鉴于它们在启动皮肤先天免疫阶段反应中的关键作用,所以也在AD中进行了探索,但目前针对这两个靶点在AD中的探索效果并不佳。
2021年5月10日,安进宣布向FDA递交了首个TSLP抗体Tezepelumab的上市申请,用于治疗重度哮喘。名为Navigator的试验结果证实,无论患者基线的嗜酸性粒细胞水平如何,tezepelumab都能显著降低哮喘年发作率(AAER)。哮喘、特应性皮炎等同属特应性疾病,不少患者也都是合并产生,大约50%的严重哮喘病例存在嗜酸性粒细胞增多症,所以与之相关的针对IL-4/IL-13的dupilumab和针对IL-5的mepolizumab都在有嗜酸性粒细胞升高的哮喘适应症中获批,但非嗜酸性粒细胞增多的哮喘一直无药可用。而其开发并不是一帆风顺,曾经在特应性皮炎适应症的II期试验失败,64.7%的患者达到EASI50终点,而安慰剂组为48.2%。
Etokimab(ANB020)是一种人源化抗人IL-33单克隆抗体。在一项包括300名患者的2b期随机中重度特应性皮炎双盲安慰剂对照的ATLAS临床研究中,etokimab各个给药组均未能达到试验的主要终点,这表明在第16周,相对于安慰剂组,湿疹面积和严重程度指数(EASI)在统计学上没有更大的改善。在早期的试验中发现能抑制中性粒细胞迁移,而在AD疾病后期中性粒细胞在炎症浸润中很少见,再生元的REGN3500在哮喘中成功,在AD中也失败了,这为IL-33抑制在特应性皮炎中的未来带来更多不确定因素。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐