每周医药看点(10.29-11.4)
- 2021-11-05 14:48
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 国家医保局发布《关于做好国家组织药品集中带量采购协议期满后接续工作的通知》;《体外诊断试剂分类规则》《境内第三类和进口医疗器械注册审批操作规范》《境内第二类医疗器械注册审批操作规范》等文件发布;2021年11月1日起中药配方颗粒备案模块正式启用……10月29日-11月4日,医药行业的这些事情值得关注。
行业政策动态
1.国家医保局发布《关于做好国家组织药品集中带量采购协议期满后接续工作的通知》,要求以省(自治区、直辖市及新疆生产建设兵团)或省际联盟为单位,依法合规,平稳开展接续工作,引导社会形成长期稳定预期。《通知》指出,原则上所有国家组织集采药品协议期满后均应继续开展集中带量采购,不得“只议价、不带量”;上一轮集采时差额中选的品种,原则上在稳定价格水平和临床用药的基础上开展询价,询价上限为上一轮全国最高中选价;把信用评价和履约情况融入接续规则各个主要环节中,使其在企业申报资格、中选资格、中选顺位、供应地区选择中发挥实质性作用。
2.国家药监局印发《体外诊断试剂分类规则》。《分类规则》明确,体外诊断试剂的管理类别应当根据产品风险程度进行判定。分类判定的总体原则是,根据风险程度由低到高,管理类别依次分为第一类、第二类和第三类。即,第一类体外诊断试剂具有较低的个人风险;第二类具有中等的个人风险和/或公共健康风险;第三类具有较高的个人风险和/或公共健康风险。
3.国家药监局印发《境内第三类和进口医疗器械注册审批操作规范》和《境内第二类医疗器械注册审批操作规范》。《规范》明确,境内第三类和进口第二类、第三类医疗器械产品注册的受理和技术审评,变更注册、延续注册、临床试验审批项目的受理、技术审评和行政审批,以及变更备案资料由国家药品监督管理局医疗器械技术审评中心负责接收。境内第三类和进口第二类、第三类医疗器械产品注册的行政审批由国家药监局负责,批件(文件)制作由国家药监局行政事项受理服务和投诉举报中心负责。
4.国家药监局综合司发布《关于启用短缺药品生产供应及停产报告信息采集模块的通知》《关于启用原料药生产供应信息采集模块的通知》,正式启用药品信息采集平台的相关模块,采集2021年第三季度以来的相关信息。目前,两个模块的信息采集工作聚焦于《国家短缺药品清单》《国家临床必需易短缺药品重点监测清单》的63个品种,其他品种及其原料药暂无要求。
5.国家药监局发布公告明确,自2021年11月1日起正式启用中药配方颗粒备案模块。中药配方颗粒生产企业可以登录国家药监局网上办事大厅(https://zwfw.nmpa.gov.cn/)提交相关资料,进行中药配方颗粒备案。为提高备案工作效率和速度,避免扎堆填报,中药配方颗粒生产企业可提前按要求将备案资料上传暂存。备案模块操作指南在上述网站“药品业务应用系统”的“通知公告”栏目中下载使用。
6.国家药监局批准颁布第二批36个中药配方颗粒国家药品标准,加上此前的第一批160个,目前已批准颁布的中药配方颗粒国家药品标准共有196个。
产品研发/上市信息
1.国家药监局批准维泰医疗器械(杭州)股份有限公司生产的创新产品“持续葡萄糖监测系统”的注册申请。该产品由一次性葡萄糖探头、葡萄糖信号发射器、葡萄糖信号接收器、血糖管理应用软件及配套附件组成。可用于糖尿病成年患者(≥18岁)的组织间液葡萄糖水平的连续或定期监测。
2.国家药监局批准深圳硅基传感科技有限公司生产的创新产品“持续葡萄糖监测系统”的注册申请。该产品由传感器套装、读取器套装或持续葡萄糖监测系统软件组成。用于糖尿病成年患者(≥18岁)的组织间液葡萄糖水平的连续或定期监测。
3.国家药监局批准北京中仪康卫医疗器械有限公司生产的创新产品“胚胎植入前染色体非整倍体检测试剂盒(可逆末端终止测序法)”的注册申请。该产品是基于新一代的高通量测序平台研制的体外诊断试剂,可对胚胎囊胚期活检细胞中染色体数目异常进行定性检测,用于定性检测试管婴儿过程中体外培养胚胎的囊胚滋养层细胞的脱氧核糖核酸(DNA)。
4.国家药监局发布2期药品批准证明文件待领信息,共包括110个受理号,涉及辉瑞制药科技有限公司等企业。(截至11月4日)

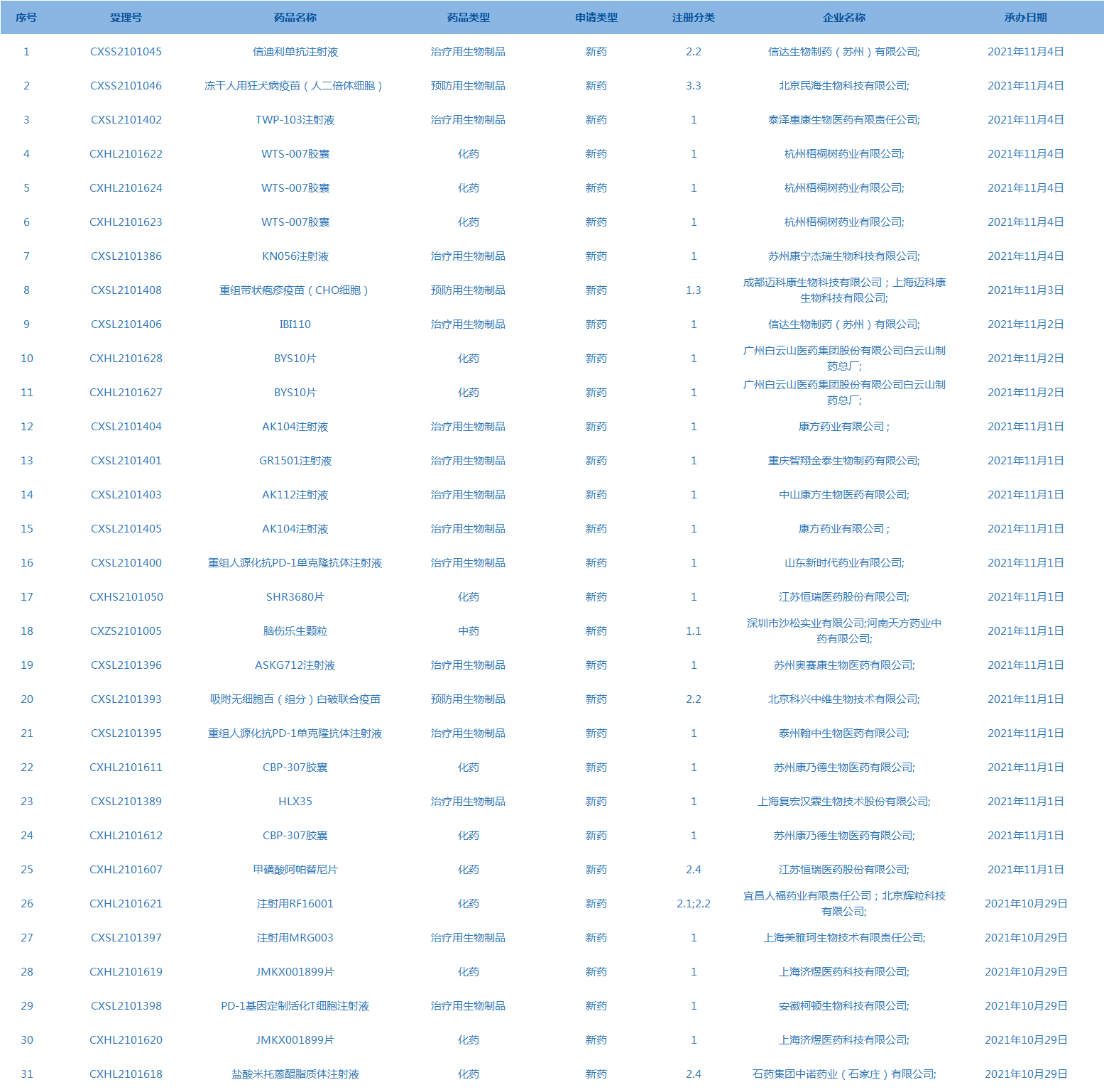
5.国家药监局发布5期医疗器械批准证明文件(准产)待领信息,共包括42个受理号,涉及常州华森医疗器械有限公司等企业。(截至11月4日)
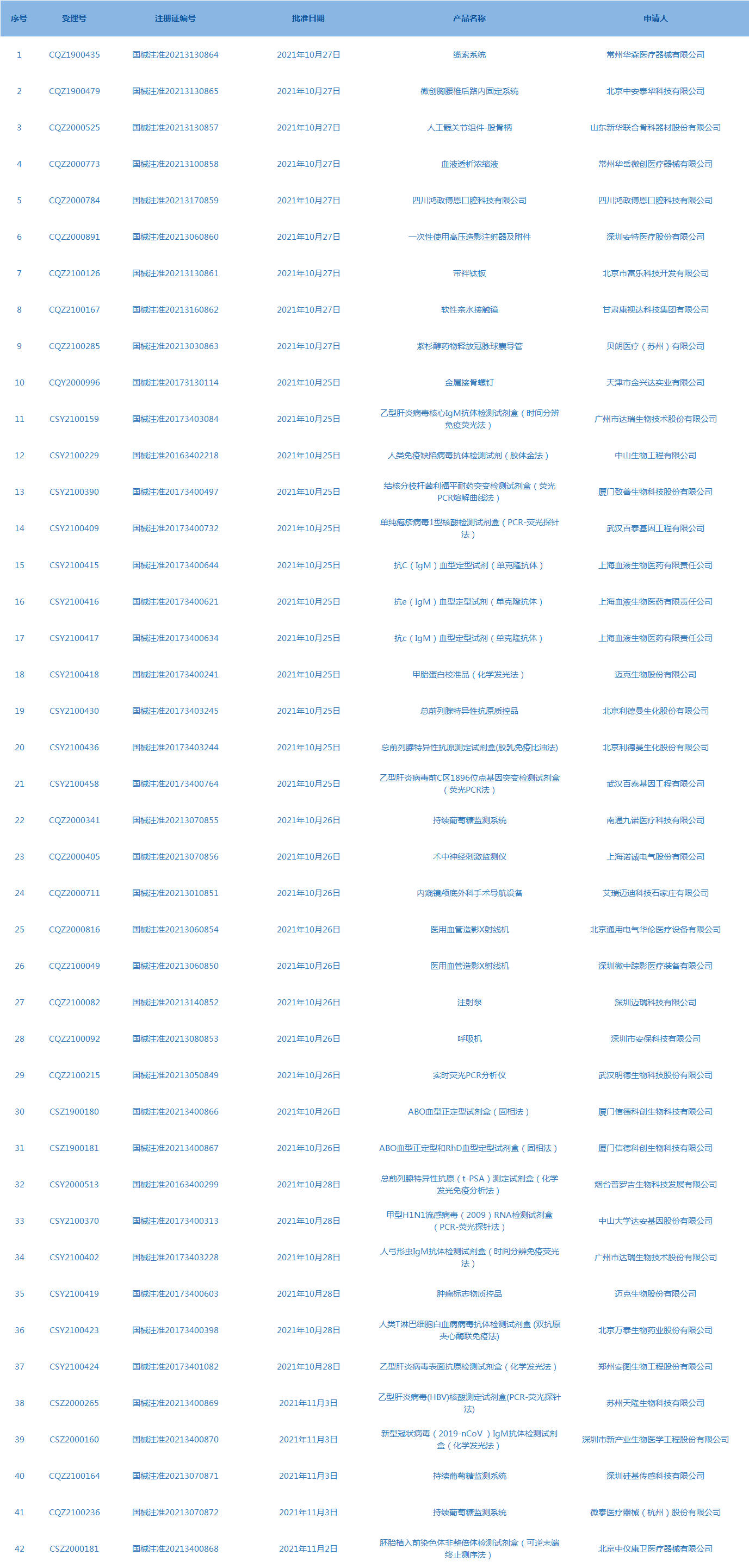
6.CDE网站公示30个仿制药一致性评价任务,涉及氨茶碱注射液等药品。(截至11月4日)
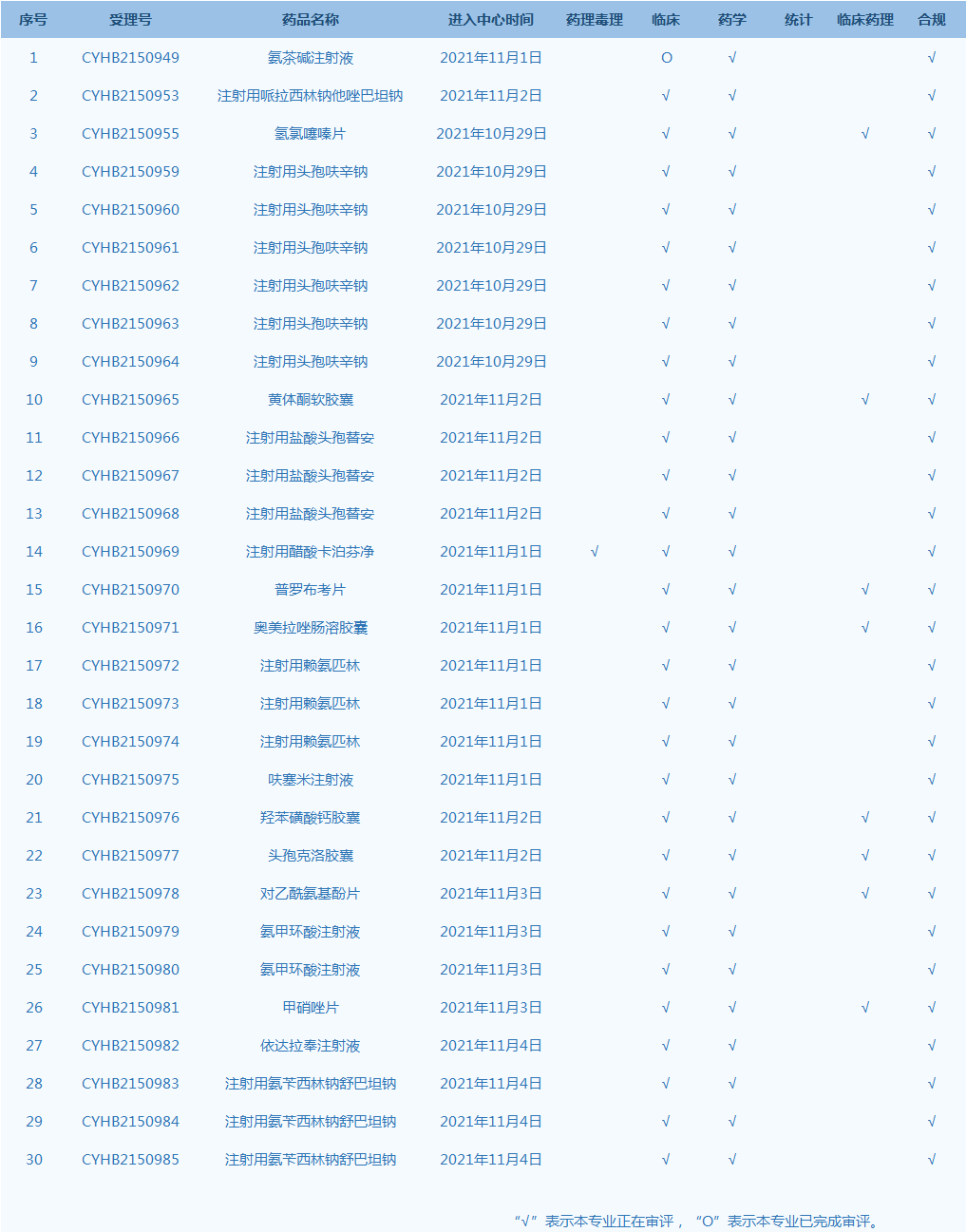
7.CDE承办受理31个新药上市申请,包括TWP-103注射液等药品。(截至11月4日)
8.国家药监局器审中心公示医疗器械优先审批申请审核结果,上海联影医疗科技股份有限公司申请的正电子发射及X射线计算机断层成像扫描系统符合优先审批情形,拟定予以优先审批。
医药企业观察
1.君实生物发布公告称,子公司TopAlliance Biosciences, Inc.特瑞普利单抗(项目代号“TAB001/JS001”)联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌患者的一线治疗和单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗的两项适应症的生物制品许可申请(BLA)获得美国FDA正式受理。
2.普利制药发布公告称,公司产品注射用伏立康唑获得哥斯达黎加卫生部上市许可。
3.翰宇药业发布公告称,公司产品醋酸特利加压素原料药收到了欧洲药品质量管理局签发的欧洲药典适用性认证(CEP)证书。
4.上海医药全资子公司上药新亚与Phagelux. Inc.签订合作协议,以不超过5,050万美元(除销售提成外)的交易金额取得抗细菌感染新药ClyO项目在中国(不包括中国台湾地区)的研发、生产、注册、经销、销售、营销、推广和再许可的权利,包含ClyO针对金葡菌导致的系统性感染适应症。
5.步长制药全资子公司四川泸州步长与郑州深蓝海医药签订《技术服务(委托)合同》,泸州步长委托深蓝海医药在国内GCP基地医院开展注射用重组人甲状旁腺素(1-84)治疗慢性甲状旁腺功能减退症有效性和安全性的多中心、随机、双盲、安慰剂对照的Ⅲ期临床研究。
6.明德生物与上海玖檬共同出资设立明德新疆生物科技有限公司。新公司注册资本为1,980万元,其中明德生物出资1,530万元,占77.2727%股权;上海玖檬出资450万元,占22.7273%股权。
7.微创医疗附属公司上海微创投资与苏州阿格斯及其现有股东签署股权转让及增资协议,微创投资同意以人民币3.723亿元的总价自阿格斯部分现有股东(卖方)收购其所持有的阿格斯38.33%的权益及向阿格斯新增注册资本(转让与增资)。
8.安济盛生物宣布完成B轮7000万美元融资。本轮融资由晨兴创投领投,君联资本、晨壹投资等机构跟投,原有投资人奥博资本、高瓴创投、广州君实等继续参投。本轮融资将用于持续推进包括AGA111在内的多个候选药物产品的国内外临床研究试验的开展、继续扩充临床前产品管线规模,以及全面加速重度骨关节肌肉疾病治疗领域的创新药物产业化进程等。
9.东软智睿宣布完成B轮2.5亿元融资。本轮融资由约印医疗基金和东软资本联合领投,联想创投跟投,A轮投资人通和毓承全额跟投。本轮融资将用于装备的研发、制造和应用,加大核心技术创新、品牌和渠道建设等。
药械集中采购
1.新疆生产建设兵团医疗保障局就《关于推动兵团药品和医用耗材集中带量采购工作常态化制度化开展的实施意见 (征求意见稿)》公开征求意见。征求意见稿明确,2022年,兵团所有医药机构(包括公立医疗机构、医保定点社会办医疗机构、医保定点药店)均应纳入兵团药品和医用耗材集中采购平台管理,实现阳光采购、应采尽采。到2025年,兵团公立医疗机构通过兵团采购平台采购药品、医用耗材数量占比分别达到90%、80%,600个品种以上药品和5类以上高值医用耗材实施集中带量采购。
2.江苏省医保局发布《关于做好省第二轮药品集中带量采购签约量填报和中选结果执行工作的通知》,明确于2021年12月31日24时起执行,同时要求填报签约量。
3.江苏省医保局发布《关于深入推进药品阳光采购的实施意见》,自2021年12月1日起施行。意见指出,将对挂网价格实行动态管理,联动全国最低价,对异常挂网价格实行预警管理,明确预警的品种、颜色标识等。
4.浙江省医保局、浙江省卫健委联合发布《关于落实国家医保谈判药品“双通道”管理机制的通知》。通知指出,要综合考虑临床价值、患者合理的用药需求等因素,对国谈药品(含同通用名仿制药和生物类似药)施行“双通道”管理。国谈药品均纳入浙江省“双通道”管理,在定点医疗机构和定点零售药店施行统一的支付政策。【中国食品药品网综合整理/刘思慧】
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐













