细胞免疫疗法百舸争流
- 2021-11-30 16:00
- 作者:王宇恒
- 来源:中国食品药品网
细胞免疫疗法是采集人体自身免疫细胞(主要为T细胞),经过体外培养,使其数量成千倍增多,靶向性杀伤功能增强,然后再回输到人体来杀灭血液及组织中的病原体、癌细胞、突变的细胞,打破免疫耐受,激活和增强机体的免疫能力。此疗法的目标是激活人体自身的免疫系统来治疗癌症,相较于传统的放化疗有巨大优势:它不直接损伤人体细胞反而增强免疫系统;可以治疗多种癌症,对很多病人都会有效;可以抑制癌细胞进化,复发率低。
免疫疗法是近几年癌症治疗领域的重大突破。到现在为止,细胞免疫治疗已经经过了几代的研究和发展。
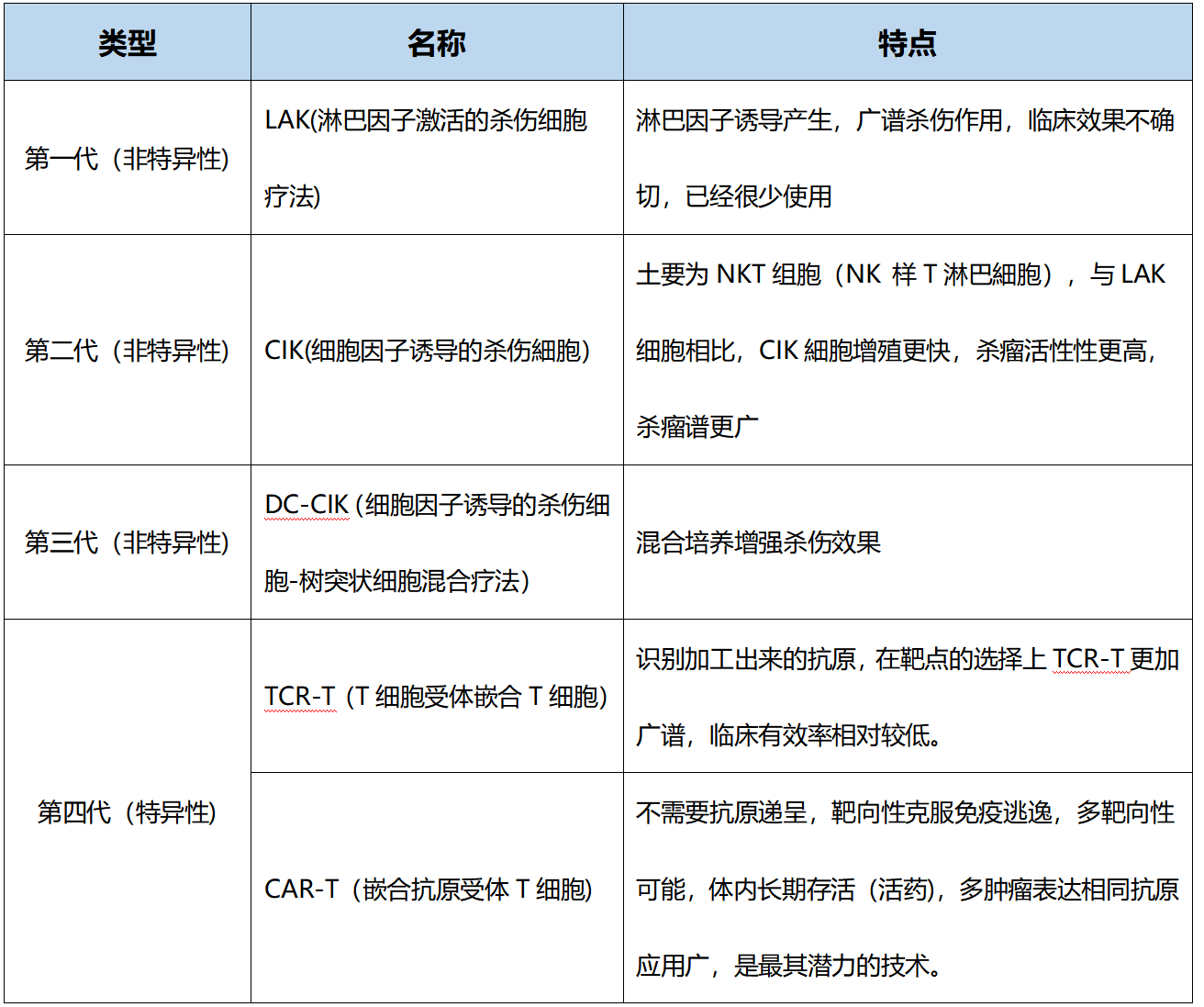
第一代细胞免疫疗法是淋巴因子激活的杀伤细胞疗法(LAK疗法);第二代是细胞因子诱导的杀伤细胞疗法(CIK疗法);第三代是细胞因子诱导的杀伤细胞-树突状细胞混合疗法(DC-CIK疗法),理论上第三代免疫疗法杀死癌细胞的能力应该更强,可惜到目前为止还没有大规模临床试验证明DC-CIK有效;就目前的研发情况来看,当前最为活跃的是第四代细胞免疫疗法——CAR-T疗法。
CAR-T疗法的原理主要是通过基因转导使患者体内的T细胞表达特异性识别肿瘤的嵌合抗原受体(CAR),将改造后的T细胞回输至患者体内,从而杀死肿瘤细胞。对于CAR-T,早在上世纪80年代,科学家就提出是否有可能通过转基因的方法使得体内的T细胞识别肿瘤细胞。作为人体内原生的细胞,癌细胞很容易逃过免疫系统的监控和杀伤,但是一旦具有了识别功能,T细胞就可以分清敌我,有效杀除癌细胞。
30年后,CAR-T终于在2011年于美国宾夕法尼亚大学实验室获得了成功:3名白血病患者中有2名得到完全缓解。到2014年10月份,30名复发难治的白血病患者中有27名得到完全缓解,完全缓解率达到90%,这是肿瘤领域革命性的进展。之所以说是革命性进展,是因为复发难治白血病患者面对的情况是3个月的死亡率为50%,3年的死亡率基本为100%,所有的药物基本上都失败了,而CAR-T技术却使过去无药可救的患者90%得到缓解。但在实际应用上,哪怕是在美国,目前也仅完成了200例左右的治疗,要想成为一个成熟可应用的技术,这个样本量还远远不够。此外,目前CAR-T主要应用于血液肿瘤的治疗,对于乳腺癌、肺癌这样的实体瘤,仍在初期研究阶段。
据药融云数据库,目前全球在研的CAR-T疗法管线有近800个,其中已经上市7款,正在提交上市申请的1款是传奇生物的CAR-T疗法,处于Ⅲ期临床试验的有5个,处于Ⅱ期临床试验的有141个,也有研发失败的案例。
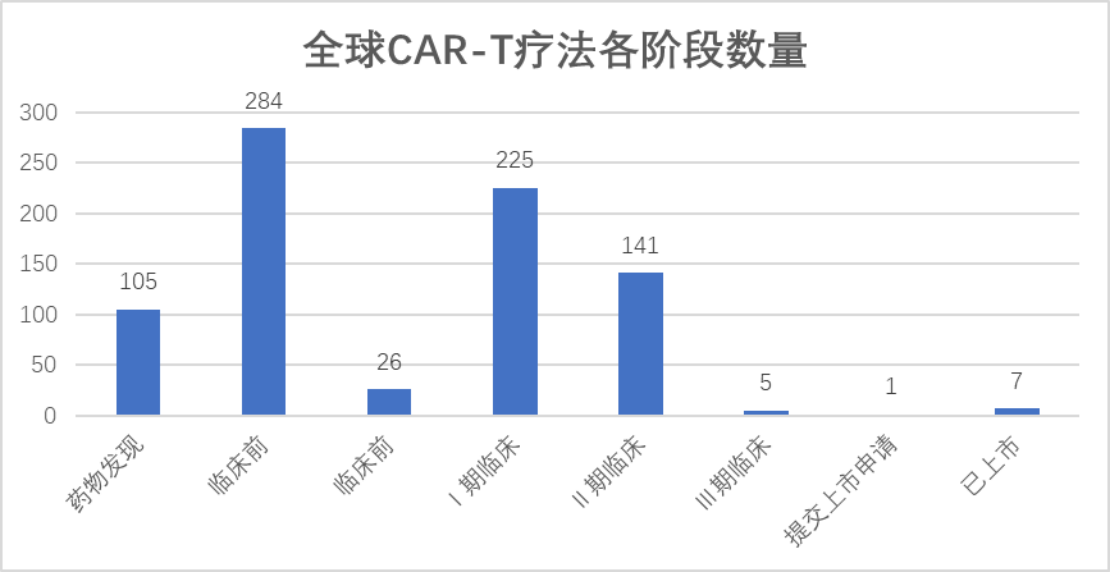
数据来源:药融云数据库
已经上市的CAR-T分别是诺华的Kymriah(tisagenlecleucel)、Gilead/Kite的Yescarta(axicabtagene ciloleucel)、吉利德的Tecartus(brexucabtagene autoleucel)、BMS的Breyanzi(lisocabtagene maraleucel)、BMS和蓝鸟生物的abecma(idecabtagene vicleucel)、复星凯特的阿基仑赛注射液、药明巨诺的瑞基仑赛注射液。除了BMS和蓝鸟生物的Abecma为APRIL靶点,其余都是CD19靶点。从适应症来看,主要集中在急性B淋巴细胞白血病、B淋巴细胞瘤、非霍奇金淋巴瘤、多发性骨髓瘤、急性淋巴细胞白血病等血液肿瘤。
表2 全球已上市的CAR-T
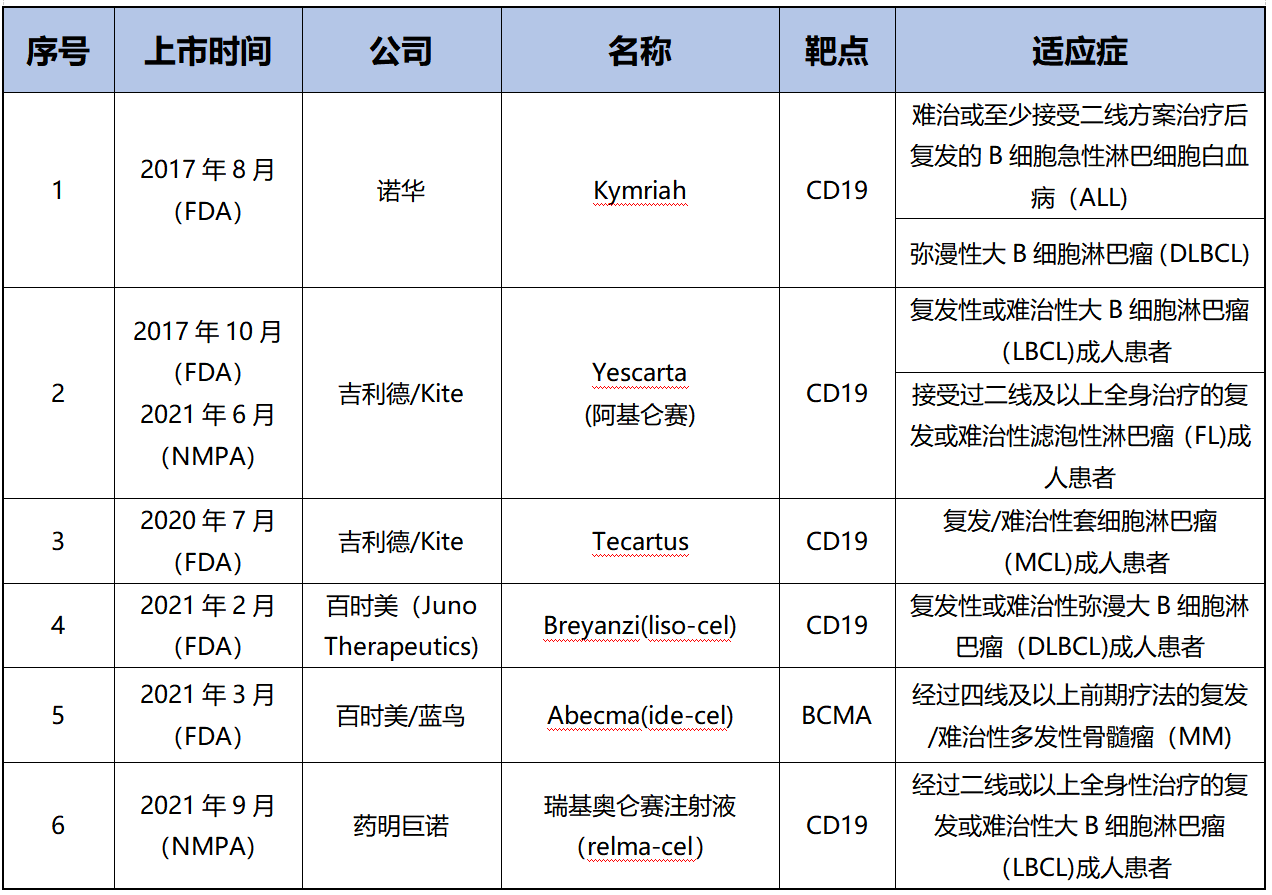
数据来源:公司财报/药融云数据库
国内的传奇生物、科济药业、博生吉、吉凯基因、茂行生物、驯鹿医疗、华夏英泰、百暨基因、优瑞科(北京)生物等公司CAR-T在研管线超过10个。有超过70家公司布局CAR-T领域,国内已经获批的是复星凯特和药明巨诺的两个产品,传奇生物的CAR-T产品西达基奥仑赛已向美国FDA提交上市申请,科济药业的Claudin18.2 CAR-T也走在了全球前列,我国在CAR-T这一赛道,已逐步处于领先地位。
同为第四代细胞免疫疗法的TCR-T技术可以追溯到2002年。当时Rosenberg团队发现,从黑色素瘤中分离出的肿瘤浸润淋巴细胞(TIL)经体外扩增回输后,可以特异性杀伤肿瘤细胞。第四代TCR-T是靶向肿瘤新抗原的高特异性细胞疗法,肿瘤应答和安全性都大幅提高。全球已经出现多款在研TCR-T疗法,其中Immunocore公司的tebentafusp(IMCgp100)进展最快,目前其治疗HLA-A*02:01阳性转移性葡萄膜黑色素瘤(mUM)成人患者的适应症申请正在欧美进行审查。多家大型跨国药企纷纷与TCR-T疗法领军企业达成合作与授权交易,我国药企也在积极布局TCR-T疗法。
2017年12月,原国家食品药品监督管理总局药品审评中心(CDE)发布《细胞治疗产品研究与评价技术指导原则(试行)》,对细胞治疗产品按照药品管理相关法规进行研发时的技术要求进行了总体阐述。此后,国家也一直在完善免疫细胞治疗方面的政策。2021年2月,CDE发布《免疫细胞治疗产品临床试验技术指导原则(试行)》,为该类产品开展临床试验的总体规划、试验方案设计、试验实施和数据分析等方面提供了必要的技术指导。相信未来我国细胞免疫治疗领域将会迎来蓬勃发展。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐












